- Preparation and Biofunctional Characterization of an Injectable Thermogel Incorporating Stem Cell Conditioned Medium and Tannic Acid
Se Yeon Shin*,#, Ryoung Eun Kim**,#, Haejin Choi*,#, Eun Young Kim**,†
 , Min Kyu Kim**, ***,†
, Min Kyu Kim**, ***,†  , and Kang Moo Huh*, ****,†
, and Kang Moo Huh*, ****,† 
*Department of Materials Science and Engineering, Chungnam National University, 99, Daehak-ro, Yuseong-gu, Daejeon 34134, Korea
**MKbiotech Inc., 99, Daehak-ro, Yuseong-gu, Daejeon 34134, Korea
***Division of Animal and Dairy Science, College of Agriculture and Life Science, Chungnam National University, 99, Daehak-ro, Yuseong-gu, Daejeon 34134, Korea
****Department of Polymer Science and Engineering, Chungnam National University, 99, Daehak-ro, Yuseong-gu, Daejeon 34134, Korea- 줄기세포 배양액 및 탄닌산 함유 주입형 써모젤 제형의 제조 및생기능적 특성 분석
신세연*,# · 김령은**,# · 최해진*,# · 김은영**,†
 · 김민규**, ***,†
· 김민규**, ***,†  · 허강무*, ****,†
· 허강무*, ****,† 
*충남대학교 신소재공학과, **엠케이바이오텍, ***충남대학교 동물자원과학부, ****충남대학교 고분자공학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Conditioned medium (CM) derived from mesenchymal stem cells (MSCs) has emerged as a promising alternative to cell-based therapies due to its high safety and regenerative efficacy. In this study, an injectable HGC-CM/TA thermogel formulation with enhanced physical and biological properties was developed by incorporating CM from placental MSCs and tannic acid (TA) into N-hexanoyl glycol chitosan (HGC). TA served as a multifunctional crosslinker, significantly improving the gel’s mechanical strength, self-healing ability, mucoadhesiveness, tissue adhesiveness, and antioxidant activity via physical and chemical interactions within the hydrogel network. All thermogels exhibited shear-thinning behavior and rapid thixotropic recovery, ensuring injectability and structural stability under physiological conditions. This HGC-CM/TA thermogel is expected to promote wound healing and tissue regeneration by providing strong adhesion for stable fixation, enhanced antioxidant activity for oxidative stress control, and convenient injectability with self-healing capacity.
중간엽 줄기세포(MSC) 유래 배양액(CM)은 높은 안전성과 조직 재생 효능을 바탕으로 세포 기반 치료를 대체할 수 있는 유망한 치료 전략으로 주목받고 있다. 본 연구에서는 N-헥사노일 글리콜 키토산(HGC)에 태반 유래 MSC 배양액과 천연 폴리페놀인 탄닌산(TA)을 도입하여, 물리적 안정성과 생물학적 기능이 향상된 주입형 HGC-CM/TA 써모젤 제형을 개발하였다. TA는 하이드로젤 내에서 물리화학적 가교를 형성하여 기계적 강도, 자가치유능력, 점막 및 조직 접착력, 항산화 활성을 효과적으로 향상시켰다. 모든 써모젤 제형은 우수한 전단 박화(shear-thinning) 거동과 점도 회복 특성을 나타내어 주입형 제형으로서의 적합성을 확인하였다. 본 HGC-CM/TA 써모젤은 강한 접착력으로 손상 부위 고정, 향상된 항산화 기능에 따른 산화 스트레스 억제, 자가치유 및 주입 편의성을 통해 상처 치유와 조직 재생을 효과적으로 촉진할 수 있는 생기능성 하이드로젤 제형으로 기대된다.
An injectable N-hexanoyl glycol chitosan (HGC)-conditioned medium (CM)/tannic acid (TA) thermogel formulation with enhanced physical and biological properties was developed by incorporating CM from placental MSCs and TA into HGC. TA served as a multifunctional crosslinker, significantly improving the gel¡¯s mechanical strength, self-healing ability, mucoadhesiveness, tissue adhesiveness, and antioxidant activity via physical and chemical interactions within the hydrogel network. The HGC-CM/TA thermogel offers a biofunctional hydrogel formulation with strong potential for various biomedical applications, including wound healing and tissue regeneration.
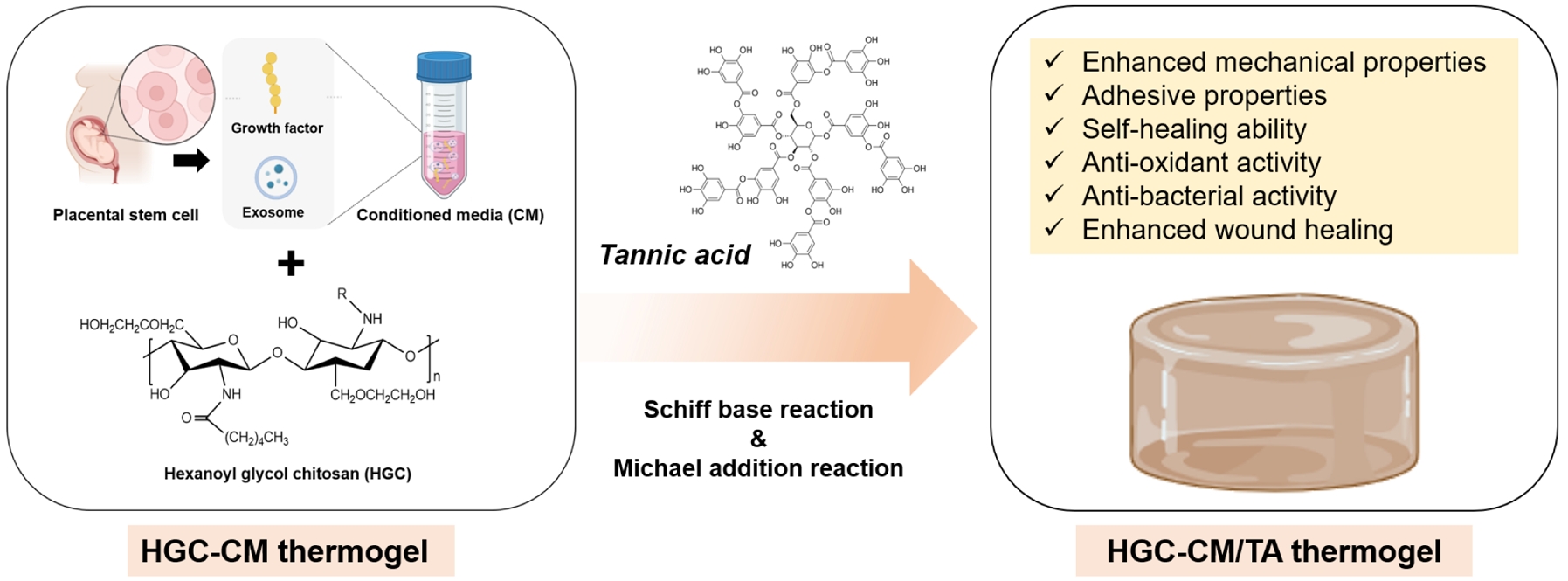
Keywords: injectable hydrogel, thermogel, N-hexanoyl glycol chitosan, conditioned medium, tannic acid.
본 연구는 과학기술정보통신부(MSIT)에 의해 지원받는 (사)한국산업기술진흥협회(KOITA)의 기업부설연구소 R&D역량강화 지원사업(2710089485), 한국연구재단의 글로벌 지역혁신 선도연구센터(RLRC) 사업(RS-2024-00405287), 및 2024학년도 충남대학교 4단계 BK21 대학원혁신사업의 지원을 받아 수행되었습니다.
저자들은 이해상충이 없음을 선언합니다.
최근 줄기세포 치료 기술의 발전은 다양한 난치성 질환 및 조직 손상에 대한 새로운 치료 전략으로 주목받고 있으며,1-3 중간엽줄기세포(mesenchymal stem cells, MSCs)는 면역조절, 조직 재생 촉진 인자 분비, 다분화능 등 우수한 생물학적 특성으로 인해 재생의학 분야에서 활발히 연구되고 있다.2,4-7 특히, 줄기세포 유래 분비체(secretome)는 세포와 세포 간의 소통을 매개하는 전달체로 중간엽줄기세포의 우수한 기능은 그대로 가지고 있으면서, 손상된 조직이나 염증 조직으로 귀소하는(homing) 성질을 가진 치료유효인자를 함유하고 있다. 세포치료제와 달리 저온에서 장기간 보관 및 운송이 용이하기 때문에 분비체를 치료제로 이용하기 위한 연구가 많이 진행되고 있다. MSCs의 활용에 있어서, 특히 태반 유래 MSCs는 윤리적 문제와 면역 거부 반응의 우려가 적고, 높은 증식력과 다분화능을 동시에 지니고 있어 상처 치유 및 조직 재생을 위한 세포 기반 치료소재로서의 활용 가능성이 높다.4,8,9
줄기세포의 주요 조직 재생 기전으로는 손상된 조직 세포로의 직접 분화(differentiation), 분비(paracrine) 효과를 통한 치료 효과, 면역조절 및 미세환경 조성 등이 알려져 있다.10-12 최근에는 세포 직접 이식보다 줄기세포 유래 분비체를 포함하는 배양액(conditioned medium, CM)을 활용하여 세포치료 효과를 구현하려는 시도가 활발히 이루어지고 있다.13-16 CM은 다양한 성장인자, 사이토카인, 엑소좀 등을 함유하고 있어 세포 증식, 이동, 혈관신생 등과 같은 조직 재생 관련 생리활성을 유도하며, 높은 안전성과 제조 용이성을 통해 임상 적용의 장점을 가진다.14,17-20
이러한 CM 기반 치료의 효과를 극대화하기 위해서는 생리활성 인자의 안정적인 전달을 위한 적절한 전달시스템이 필수적이며,15,21,22 이 중 온도감응성 하이드로젤인 써모젤(thermogel)은 체온 조건에서 in situ로 졸-젤 상전이를 일으켜 주입이 용이하고, 세포 생존 및 생착에 적합한 미세환경을 제공할 수 있어 유용한 시스템으로 평가받고 있다.23-25
최근에 보고된 새로운 천연고분자 기반 온도감응성 하이드로젤인 N-헥사노일 글리콜 키토산(N-hexanoyl glycol chitosan, HGC)은 낮은 임계 젤화 농도, 우수한 물리적 안정성, 생체적합성 등 우수한 특성으로 주입형 전달 제형으로 활용가능성이 높은 것으로 알려져 있다.26-28 그러나, HGC 써모젤은 기존 써모젤과 비교하여 보다 향상된 물리화학적 특성에도 불구하고, 높은 생체안정성과 생리활성을 요구하는 조직 재생 응용에 있어 기계적 물성과 생기능적 부여 측면에서 여전히 한계가 존재한다.29,30
이에 본 연구에서는 HGC를 기반으로, 태반 유래 MSC 배양액(CM)과 천연 폴리페놀 화합물인 탄닌산(tannic acid, TA)을 통합하여 조직 재생을 위해 기계적 특성과 생기능성이 향상된 새로운 주입형 써모젤 제형 (HGC-CM/TA)을 제조하였다. TA는 산화 시 생성되는 퀴논(quinone) 구조를 통해 아민기와의 Michael addition 반응이 가능하며, 다수의 페놀기 기반 수소결합 및 Schiff base 반응을 유도할 수 있다.31-35 이러한 다양한 반응들을 기반으로 TA는 써모젤 네트워크 내에서의 화학적 또는 물리적 가교 형성을 통해 기계적 물성, 구조적 안정성 및 자가치유특성 등 다양한 물리화학적 특성 향상에 기여할 수 있을 뿐 아니라, 항산화, 점막 및 조직 접착성 등과 같은 유용한 생기능성을 부여하는 물질로 알려져 있다.35-38 태반 유래 MSC-CM은 기존 HGC 써모젤의 부족한 생리활성을 부각시켜 줄 수 있을 것으로 기대된다.
따라서, 본 연구에서는 HGC, CM, TA의 다양한 기능을 통합하여 HGC-CM/TA 써모젤를 제조하고, 그 구조적 안정성, 유변학적 거동, 자가치유 특성, 항산화 능력, 조직 및 점막 부착성, 세포 독성 등에 대한 다각적 특성 평가를 수행하였다. 이를 통해 본 써모젤 제형이 조직 재생, 상처 치료, 주입형 치료제 개발 등 다양한 재생의학 분야에서 유용한 다기능성 전달 플랫폼으로서의 활용 가능성을 평가하고자 하였다.
재료. 글리콜 키토산(GC, DP≥400)은 Wako Pure Chemical Industries, Ltd.(일본)에서 구입하였다. Hexanoic anhydride(HA, 97%)는 Sigma-Aldrich(미국) 제품을 사용하였다. 합성 용매로는 3차 증류수 및 메탄올(99.5%)을 사용하였으며, 메탄올은 삼전화학(한국)에서 구매하였다. 침전 용매로 아세톤(99.5%)은 삼전화학(한국)에서 구매하여 사용하였다. 투석막은 Spectrum Laboratories(미국)의 Spectra/Por 4 Dialysis Tubing(MWCO= 12-14 kD)을 사용하였다. 용매인 Dulbecco’s Phosphate Buffered Saline(DPBS)은 Cytiva(미국)에서 구매하였다. NMR 분석용매로 사용한 D2O는 Sigma-Aldrich(미국) 제품을 사용하였다. Tannic acid는 Alfa Aesar Co. Ltd.(중국) 제품을 사용하였다. 2,2-diphenyl-1-picrylhydrazyl(DPPH, free radical, 95% purity)와 2,2-azino-bis-3-ethylbenzothiazoline-6-sulfonic acid(ABTS)는 GibcoTM(Thermo Fisher Scientific, 미국)에서 구매하였다.
HGC의 합성. HGC 고분자는 Figure 1(a)와 같이 기존에 보고된 실험 방법을 따라 GC의 N-hexanoylation 반응을 통해합성되었다.30 GC(3.0 g)를 실온에서 375 mL의 3차 증류수에 용해한 후, 375 mL의 메탄올을 첨가한다. HA 1.15 mL를 첨가하고 실온에서 24시간 동안 교반 하에 반응시킨다. 반응 후, 반응 용액을 아세톤에 침전시키고, 침전물을 중력 여과를 이용하여 수거하였다. 잔류 용매 및 미반응물 정제를 위하여 샘플을 증류수에 용해하고, MWCO가 12-14 kD인 투석막을 이용하여 3차 증류수에서 48시간 동안 투석 과정을 거친 후, 동결건조를 통해 분말 형태의 HGC 고분자를 얻었다.
합성된 HGC의 화학적 조성 분석을 위해 1H NMR과 ATR-FTIR 분석을 수행하였다. 1H NMR 분광기로 AVANCE III 400 spectrometer(Bruker, 독일)를 사용하였고, HGC 분석샘플은 D2O 용매를 사용하여 0.5 wt% 농도에서 1H NMR스펙트럼을 얻었다. D2O의 4.81 ppm을 기준 피크로 설정하였다. 이를 통해 HGC의 hexanoylation 정도는 37.2%임을 확인하였다. ATR-FTIR 분석은 Nicolet iS5 spectrometer(Thermo Scientific, 미국) 제품을 이용하여 4000-750 cm-1 범위에서 8 cm-1의 해상도로 32회 스캔하여 수행되었다.
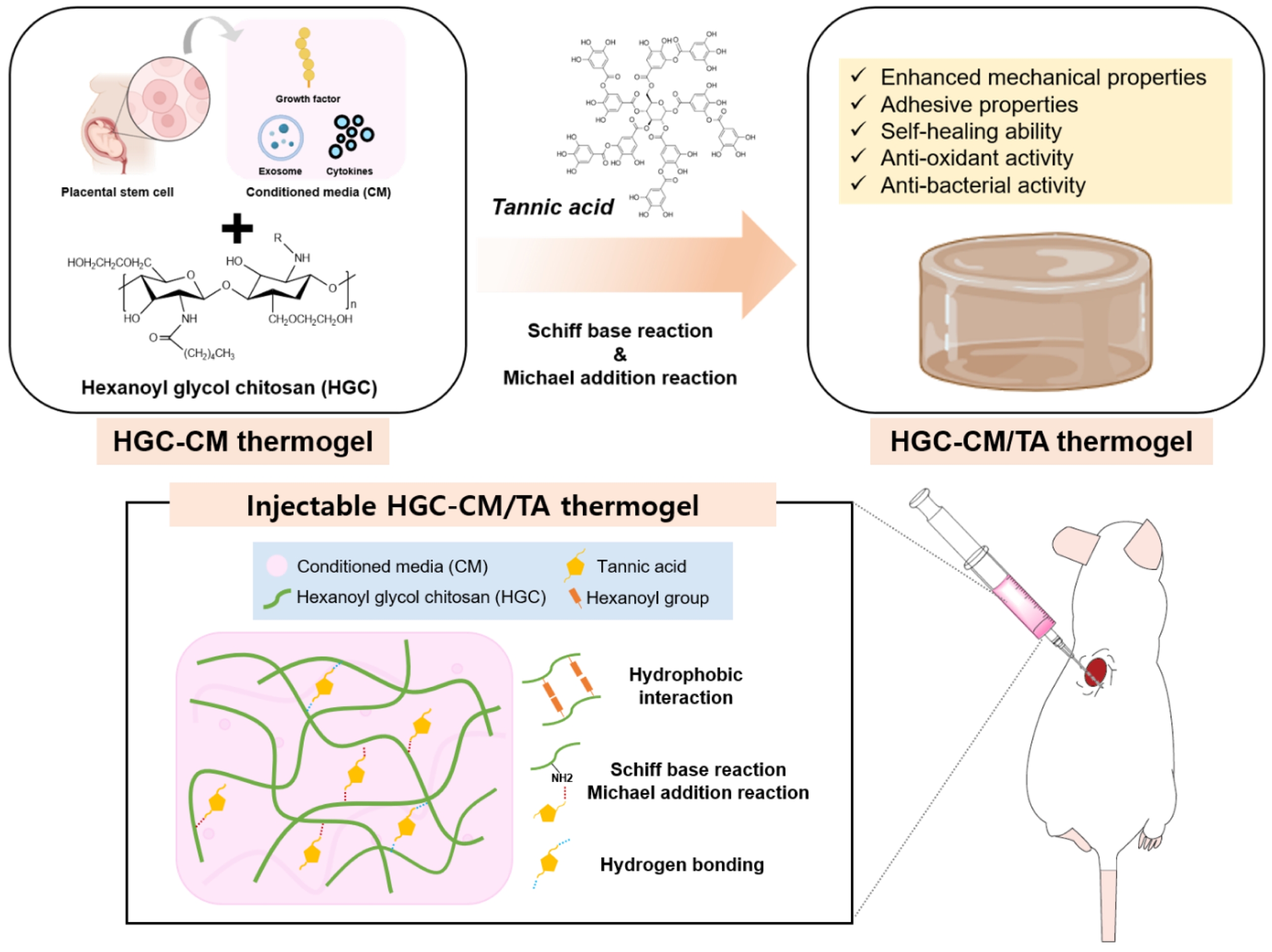
Scheme 1. Schematic illustrations for preparation of injectable multifunctional HGC-CM/TA thermogel (created with Biorender.com).
줄기세포 배양액 수집. 줄기세포 CM의 제조를 위한 말 양수 유래 중간엽 줄기세포(Equine amniotic derived mesenchymal stem cell, EAF)의 분리 및 확보 과정은 충남대학교 동물실험윤리위원회의 승인을 받았으며(Approval No. 202203-CNU-002), 특성 분석을 완료한 후 실험에 활용하였다.39 CM을 확보하기 위해 passage 7 이하의 EAF를 Dulbecco’s Eagles’s medium(DMEM, GibcoTM, 미국)과 15% (v/v) Fetal Bovine Serum(FBS, GibcoTM, 미국) 및 1%(w/v) penicillin/streptomycin (P/S, GibcoTM, 미국)를 첨가한 media에서 24시간 동안 배양한 후, 세포 밀도가 약 30% confluency에 도달했을 때, serum-free media(SFM, MKbiotech, 한국)로 배지를 교체하였다. 이후 48 시간이 경과한 시점에서 상층액을 수집하였으며, confluency가 80% 이상이 되지 않았을 때 획득하였다. 이 상층액에서 죽은 세포 및 debris와 같은 물질을 제거하기 위하여 여러 차례 원심분리 과정을 거쳐 정제한 후, 사용 전까지 -80 ℃에서 보관하였다.
HGC 써모젤 제형 제조. HGC 써모젤을 DPBS 용액(pH=7.4, 0.01M)에 3 wt% 농도로 용해시켜 준비하였다. HGC-CM 써모젤 제형은 3 wt% 농도로 HGC를 CM 용액에 용해하여 제조하였다. HGC-CM/TA 써모젤은 HGC를 3 wt% 농도로, TA는 HGC 중량 대비 3% 농도로 CM용액에 혼합하여 제조하였다. HGC 써모젤 제형의 조성 및 분자 간 결합 특성을 분석하기 위해 ATR-FTIR 분석을 수행하였다.
FE-SEM 분석. 써모젤 제형 내부의 형태학적 구조를 관찰하기 위해 주사전자현미경(FE-SEM, S-4800, Hitach, 일본)을 이용하여 써모젤의 단면을 관찰하였다. HGC, HGC-CM, HGC-CM/TA 써모젤을 37 ℃에서 2일간 안정화 및 산화 과정을 거친 후, 액체질소를 이용한 급속 냉동 후 3일간 동결건조하였다. 건조된 샘플은 단면이 노출되도록 절단한 후, SEM 홀더에 부착하였다. 비전도성 써모젤의 전하 축적을 방지하고 이미지의 해상도를 높이기 위해 샘플을 아르곤 가스 환경에서 90초 동안 백금 코팅 후 분석하였다.40
유변학적 특성 분석. 써모젤 제형의 온도에 따른 유변학적 거동 변화를 관찰하기 위해 레오미터(HR-10 Rhometer, TA instruments, 미국)를 활용하여 분석하였다. 샘플 측정은 직경 40 mm의 두 평판 사이에 1 mm 간격 조건에서 진행되었다. 가열 속도는 1 ℃/min, 온도 범위는 10-50 ℃, 진동수는 1 Hz로 고정하였으며, 10 Pa의 일정한 응력을 가하여 측정하였다.
주입형 특성(injectability) 평가. 써모젤의 주입형 특성을 분석하기 위해 레오미터(HR-10 Rheometer, TA instruments, 미국)를 사용하여 shear-thinning 거동과 thixotropic 거동을 관찰하였다. shear-thinning 거동 분석을 위해 직경 40 mm의 평판을 사용하였으며, 25 ℃에서 전단속도 0.01-100 s-1 범위 내에서 flow ramp 방식으로 점도 변화를 측정하였다. 써모젤의 thixotropic 거동 분석은 rotational recovery test를 37 ℃에서 진행하였다. 200초 동안 전단 속도 0.1 s-1을 가한 후, 100초 동안 100 s-1의 전단 속도를 가하는 사이클을 반복하여 점도의 회복 거동을 평가하였다.26
시간에 따른 유변학적 특성. 써모젤의 시간에 따른 유변학적 특성 분석을 수행하여 산화 시간에 따른 저장 탄성률(storage modulus)의 변화하는지를 관찰하였다. 이를 위해 레오미터(HR-10 Rheometer, TA instruments, 미국)를 이용하여 37 ℃에서 고정된 10 Pa 응력과 1 Hz의 주파수 하에서 time sweep 기법으로 60초 동안 저장 탄성률을 측정하였다. 샘플은 직경 20 mm, 간격 1000 μm의 두 평판 사이에 배치되었다. 각 샘플의 유변학적 거동을 0시간, 3시간, 6시간, 12시간, 24시간, 48시간 간격으로 측정하였다.34
자가치유능 평가. HGC-CM/TA 써모젤의 자가치유 특성을 평가하기 위해 먼저 육안 관찰을 실시하였다. 이를 위해 젤화가 완료된 HGC-CM/TA 써모젤을 두 개의 조각으로 절단한 후, 상온(25 ℃)에서 30분간 접합시켜 물리적 회복 거동을 관찰하였다.
정량적 분석을 위해 HGC-CM/TA 써모젤의 유변학적 특성은 레오미터(HR-10 Rheometer, TA instruments, 미국)을 이용하여 측정하였다. 샘플은 직경 20 mm의 티타늄 평판 사이에 배치하고, 평판 간격은 1000 μm로 설정하였다. 먼저, 진동 진폭 테스트를 통해 점탄성 붕괴 임계점을 확인하기 위해 1.0 Hz 조건에서 변형률(γ)을 1.0%에서 5000.0%까지 점진적으로 증가시키며 저장탄성률(G′)과 손실탄성률(G″)의 변화를 측정하였다.
이후, alternate step strain sweep test를 통해 자가치유 특성을 평가하였다. 이 실험에서는 작은 변형률(γ=1.0%)과 큰 변형률(γ=5000.0%)을 각각 60초 간격으로 번갈아 적용하면서, 고정 주파수 1.0 Hz 및 온도 25 ℃ 조건 하에서 G′의 회복 정도를 관찰하였다.37,41
항산화 능력 평가. HGC, HGC-CM, 그리고 HGC-CM/TA 써모젤의 항산화 활성을 정량적으로 분석하기 위해 대표적인 라디칼 소거 분석법인 DPPH 및 ABTS 시험을 수행하였다. DPPH 라디칼 소거능 평가는 0.2 mM 농도의 DPPH 용액을 메탄올에 용해하여 준비하였으며, 광분해를 방지하기 위해 암조건에서 보관하였다. 각 써모젤 샘플(0.5 mL)을 DPPH 용액(1.5 mL)과 혼합하여 암조건에서 30분 반응시킨 후 젤을 제거하였다. 남아있는 DPPH 용액의 흡광도를 517 nm에서 UV-vis spectrophotometer(SINCO, 한국)을 이용하여 측정하였다. 대조군으로 DPPH 단독 용액을 사용하였으며, 흡광도 차이를 계산하여 라디칼 소거 활성을 평가하였다(n=3). ABTS 라디칼 소거능 평가는 7 mM ABTS 용액과 2.4 mM 과황산칼륨(potassium persulfate)을 1:1(v:v) 비율로 혼합하여 암조건에서 12-16 시간 반응시켜 ABTS 라디칼 용액을 제조하였다. 이후, 해당 용액을 메탄올로 희석하여 734 nm에서 흡광도가 0.7(±0.01)이 되도록 조정하였다. 이후, 각 써모젤 시료(0.5 mL)를 ABTS 용액(1.5 mL)과 혼합하여 암조건에서 30 분 동안 반응시킨 후, 써모젤을 제거한 후 남은 용액의 흡광도를 측정하였다. ABTS 단독 용액을 대조군으로 사용하였으며, 734 nm에서의 흡광도 차이를 이용하여 라디칼 소거 활성을 분석하였다(n=3).42
압축강도 측정. HGC, HGC-CM, 그리고 HGC-CM/TA 써모젤의 기계적 강도를 정량적으로 평가하기 위해 압축 시험을 수행하였다.각각의 샘플은 직경 10 mm, 높이 10 mm의 원기둥 형태로 성형한 후, texture analyzer(EZ-SX, Shimadzu, 일본)에 500 kN load cell을 장착하여 측정하였다. 시험은 5 mm/min의 일정한 cross head 속도로 측정하였다. 각 샘플은 동일한 조건에서 3번 반복 측정하였다. 측정된 압축 강도는 표준 편차를 포함한 평균 값으로 나타냈다.43
점막 부착 특성 평가. HGC, HGC-CM, 그리고 HGC-CM/TA 써모젤의 점막 부착성(mucoadhesiveness)을 평가하기 위해, 각 써모젤을 뮤신과 1:1의 무게 비율로 혼합하였다. 혼합된 시료는 유변학적 분석을 위해 레오미터(HR-10 Rheometer, TA instruments, 미국)를 사용하여 oscillation frequency sweep 시험을 진행하였다. 직경 20 mm 티타늄 평판 사이에 1000 μm 간격을 설정하고, 37 ℃를 유지하였다. 저장 탄성률(G')은 0.1-10 Hz의 주파수 범위에서 측정하였으며, 모든 측정은 세 번 반복 수행한 후 평균값(n=3)으로 나타내었다.
써모젤과 뮤신 간의 상호작용을 나타내는 시너지 매개변수는(ΔG') 다음 공식에 따라 계산되었다.44

여기서 G′mix는 써모젤-뮤신 혼합물의 저장 탄성률, G′p는 단일 써모젤의 저장 탄성률을 의미하며, ΔG′가 0보다 클 경우 점막 부착 특성을 갖는다.
조직 접착 특성 평가. 써모젤의 조직 접착력을 측정하기 위해 인간 피부와 유사한 돼지 피부 조직을 시험 재료로 사용하였다. 우선, 돼지 피부를 10 mm×10 mm 크기로 절단한 후, pH7.4의 PBS 용액에 37 ℃에서 1시간 침지하여 수화시킨 뒤, 표면의 지방을 제거하였다. 이후, 피부 조직은 10 mm ×50 mm 크기로 절단된 polyimide 필름에 접착제를 사용해 부착하였다. 써모젤 샘플을 두 개의 준비된 피부 조직 사이에 도포한 후, 겹쳐진 접착 부위를 금속 클립으로 고정하고 37 ℃에서 6시간 동안 보관하여 접착이 충분히 이루어지도록 하였다. 접착된 샘플의 접착 강도는 500 kN load cell을 장착한 texture analyzer(EZ-SX, Shimadzu, 일본)을 이용하여 5 mm/min의 일정한 속도로 측정하였다. 각 실험은 동일한 조건에서 세 번 반복하여 수행하였으며, 평균값과 표준편차로 보고하였다.34
세포 독성평가. HGC, HGC-CM, 그리고 HGC-CM/TA 써모젤의 생체적합성은말 피부 유래 섬유아세포(horse skin fibroblasts)를 이용해 수행되었다. 정량적 평가는 MTT 세포 생존율 분석법을 사용하였고, 정성적 세포 생존 이미징은 LIVE/DEADTM viability/cytotoxicity 분석 키트(Invitrogen, 미국)를 통해 진행되었다.
먼저, 각 써모젤 시료(HGC, HGC-CM, HGC-CM/TA) 0.5 mL를 6-well plate에 분주하여 37 ℃에서 3시간 동안 젤화를 유도하였다. 그 후, 각 well에 DMEM 2 mL(10%(v/v) FBS 및 1%(w/v) P/S 포함)를 첨가하여 24시간 동안 배양하였으며, 이로부터 용출액(eluted solution)을 확보하였다.
MTT 분석을 위해, 세포를 96-well plate에 1×104개씩 분주한 뒤, 5%의 CO2가 유지되는 37 ℃ 인큐베이터에서 24시간 동안 배양하였다. 이후, 준비된 용출액을 DMEM으로 10배 희석한 뒤 well 당 200 μL씩 세포와 37 ℃에서 48시간 동안 재배양하였다. 각 well에 MTT 용액을 첨가한 뒤 37 ℃에서 일정 시간 동안 반응시킨 후, 생성된 포마잔(formazan)을 DMSO로 용해시켜 마이크로플레이트 리더기(Biotek Epoch, Agilent, 미국)를 이용해 570 nm에서 흡광도를 측정하였다. 세포 생존율을 다음과 같은 식을 통해 계산하였다.

LIVE/DEAD 분석에서는 말 피부 섬유아세포를 24-well plate에 well 당 2×104개씩 분주하고, 24시간 동안 배양한 뒤, DMEM으로 10배 희석한 용출액을 200 μL씩 각 well에 첨가하여 추가로 48 시간 배양하였다. 이후 2 μM Calcein-AM과 4 μM Ethidium homodimer-1이 포함된 염색용액을 처리하고 37 ℃에서 15분간 반응시킨 후 PBS로 세척하였다. 최종적으로, 형광현미경(Leica, 독일)을 통해 세포 생존율을 분석하였다.34
|
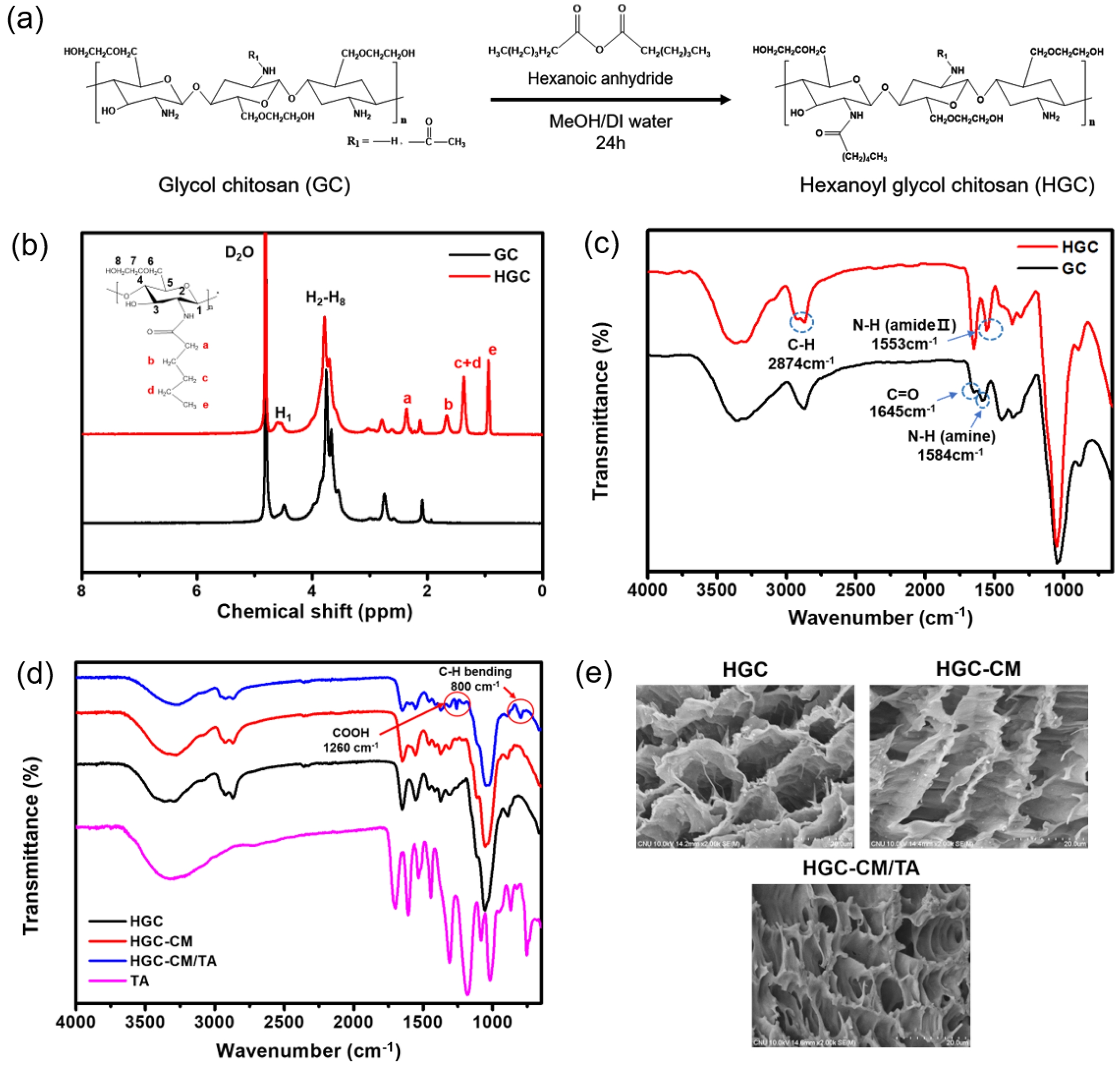
Figure 1 Characterization of HGC and its derived thermogels: (a) synthetic scheme of HGC; (b) 1 H NMR spectra of GC and HGC; (c) ATRFTIR spectra of GC and HGC; (d) ATR-FTIR spectra of HGC, HGC-CM, and HGC-CM/TA; (e) FE-SEM images of HGC, HGC-CM, and HGC-CM/TA. |
써모젤의 제조 및 분석. 본 연구에서는 HGC을 기반으로 한 써모젤을 성공적으로 합성하였으며, 합성 결과를 1H NMR과 ATR-FTIR 분석을 통해 확인하였다. Figure 1(a)에 도시된 바와 같이, GC의 자유 아민기에 소수성 N-헥사노일기를 일정 치환율로 도입하여 온도감응성 젤 형성능을 갖는 HGC 써모젤을 합성하였다.
Figure 1(b)에 GC와 HGC의 1H NMR 스펙트럼을 비교하여 제시하였다. GC는 δ=3.5~4.0 ppm 구간에서 글루코피라노실 고리의 2번부터 8번 위치 수소 피크를 보였다. HGC에서는 추가적으로 δ=0.89 ppm(메틸기), δ=1.3, 1.6, 2.3 ppm(메틸렌기)에 해당하는 피크가 새롭게 관찰되었다. 이는 헥사노일기 도입에 따른 특이적 피크로서, 이를 통해 N-헥사노일화를 통한 HGC의 합성이 성공적으로 이루어졌음을 확인하였다. 글루코피라노실 고리의 수소 피크와 헥사노일기의 피크 적분 값을 비교하여 HGC의 치환율(degree of hexanoylation, DH)을 계산한 결과, 치환율이 37.2%로 확인되었다.
또한, ATR-FTIR 분석(Figure 1(c))을 통해 HGC의 구조 변화를 확인하였다. GC는 3400 cm-1에서 -OH기와 N-H 신축 진동 피크에 해당하는 넓은 피크를, 1584 cm-1에서는 아민기의 N-H 굽힘 진동 피크를 나타내었다. 반면, HGC에서는 N-H 신축 진동 피크 감소와 함께 1553 cm-1에서 amide II 굽힘 진동에 해당하는 새로운 흡수 피크가 관찰되었다. 이는 헥사노일기 도입으로 인한 아마이드 결합 형성을 의미하며, N-헥사노일화 반응이 성공적으로 이루어졌음을 증명한다.26
추가적으로 HGC 기반 태반 유래 중간엽줄기세포 배양액(CM) 및 천연 폴리페놀인 TA을 첨가하여 다기능성 HGC-CM/TA 써모젤을 개발하였다(Table 1). HGC-CM/TA는 3 wt% HGC에 HGC 대비 3% 무게 비율의 TA를 첨가하여 제조되었으며, ATR-FTIR 분석 결과(Figure 1(d))를 통해 각 구성 성분의 특성을 확인할 수 있었다. HGC와 HGC-CM은 유사한 스펙트럼을 보였으나, HGC-CM/TA 써모젤에서는 약 800 cm-1 부근에서 TA의 방향족 C-H 굽힘 진동, 그리고 1260 cm-1 부근에서 TA의 카복실기와 HGC 간의 에스터 결합 형성에 기인한 C-O 신축 진동이 관찰되었다. 이는 TA의 산화적 변환에 따른 구조 변화와 함께 HGC와 TA 사이의 물리화학적으로 결합 형성이 이루어졌음을 의미한다.
써모젤의 다공성 내부구조 형태를 주사전자현미경(FE-SEM)을 통해 관찰하였다(Figure 1(e)). HGC와 HGC-CM 써모젤의 경우 비슷한 크기의 서로 연결된 다공성 구조를 갖는 반면, HGC-CM/TA 써모젤은 TA 도입에 따라 가교 밀도가 현저히 증가한 구조를 나타냈다. 이러한 구조적 강화는 써모젤의 기계적 안정성 향상뿐 아니라, CM 유래 성장인자의 지속적인 전달에 유리한 환경을 제공할 수 있고, 이는 치료효과 검증을 위한 추가 연구과정에서 검증될 수 있을 것으로 사료된다.14
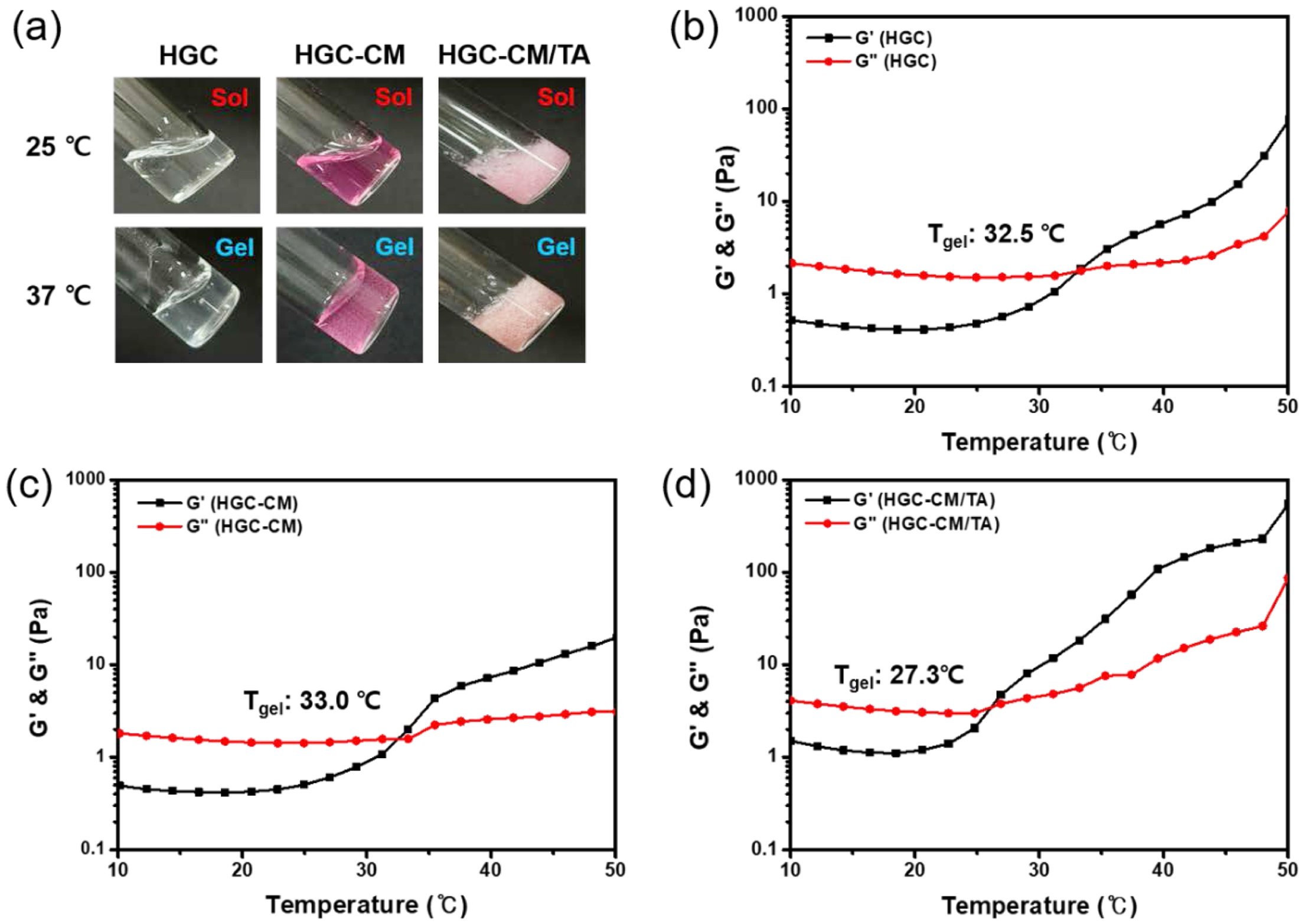
온도에 따른 유변학적 특성 평가. HGC, HGC-CM, 및 HGC-CM/TA 써모젤의 온도 감응 특성을 평가하기 위해 10-50 ℃의 온도 구간에서 유변학적 분석을 수행하였다(Figure 2). 모든 샘플에 대해 저장탄성률(storage modulus, G')과 손실 탄성률(loss modulus, G'')을 측정하였으며, 두 값이 교차하는 지점의 온도를 졸-젤 전이 온도라고 정의하였다. 온도를 일정한 속도로 상승시키며 측정한 결과, HGC 및 HGC-CM 써모젤은 각각 32.5 ℃, 33.0 ℃에서 졸-젤 상전이가 발생하여 유사한 상전이 온도를 나타내었다. 반면, HGC-CM/TA 써모젤은 27.3 ℃에서 졸-젤 상전이가 관찰되어, 다른 두 써모젤보다 낮은 전이 온도를 나타내었다. 이는 TA의 방향족 고리에 의한 소수성 상호작용이 HGC의 헥사노일기와 협력적으로 작용함으로써, 고분자 간 상호작용을 강화하고 젤 형성에 필요한 임계 온도를 낮춘 것으로 사료된다.
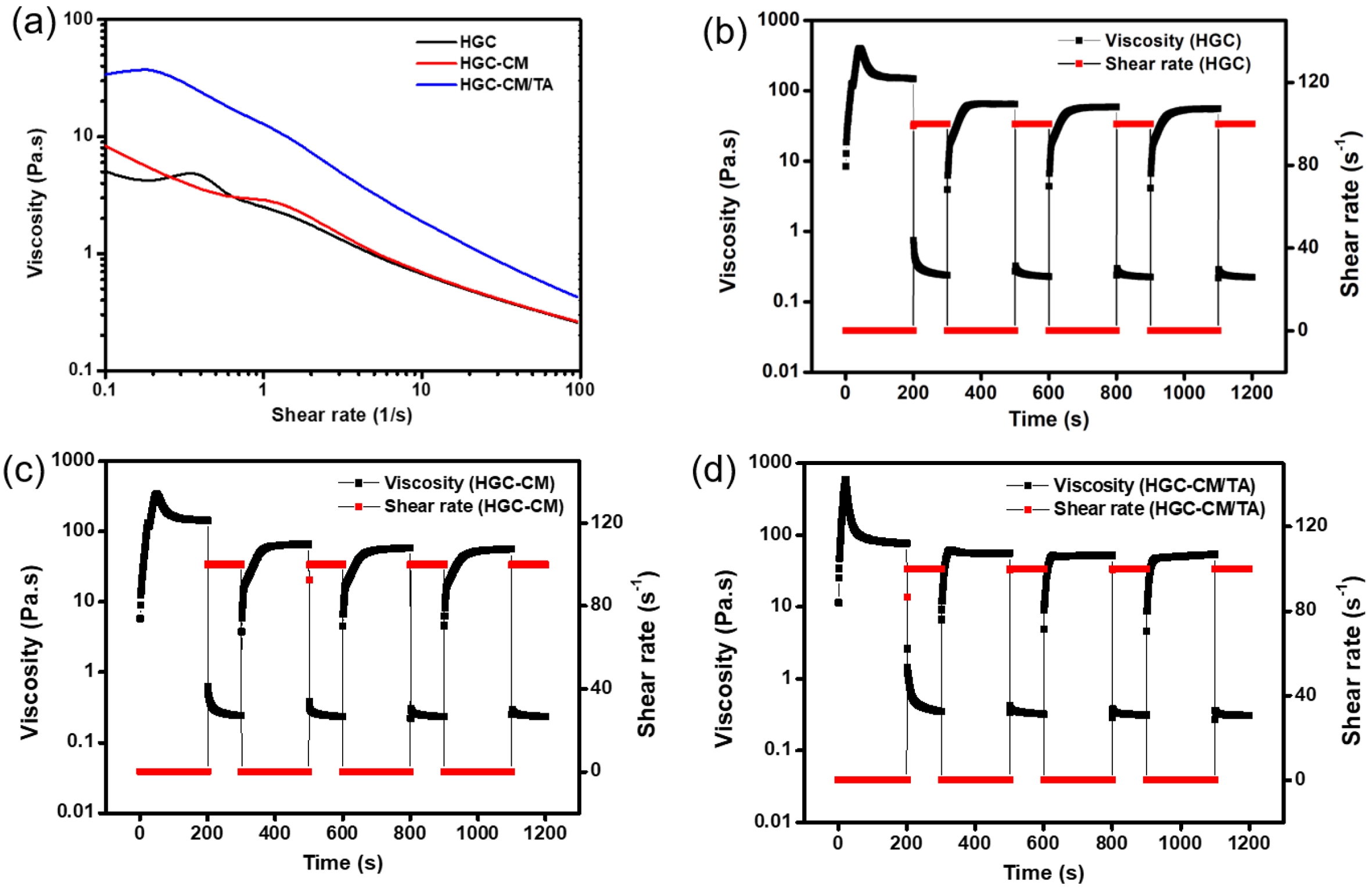
주입성(injectability) 평가. HGC 기반 써모젤 제형의 주입 특성과 점도 회복력을 평가하기 위해 레오미터의 flow ramp 모드를 이용하여 유변학적 분석을 수행하였었다(Figure 3(a)). 25 ℃ 조건 하에서 전단 속도를 점진적으로 증가시키며 점도 변화를 측정한 결과, HGC, HGC-CM, HGC-CM/TA 모든 제형에서 전단 속도 증가에 따라 점도가 감소하는 전단박화(shear-thinning) 특성이 확인되었다. 이러한 특성은 시린지 기반 주입 시 요구되는 낮은 점도 유지와 주입 압력 감소에 유리하며, 써모젤 제형이 주입형 제형으로 적합한 것으로 사료된다. 또한, 주입 이후 높은 전단력에 대한 빠른 점도 회복을 의미하는 thixotropic 거동을 분석하였다. Recovery 특성은 37 ℃에서 서로 다른 전단 속도를 반복 적용하며 점도 회복 여부를 통해 평가하였고, 이러한 시험을 4회 반복한 결과, 모든 제형에서 우수한 탄성 회복력이 관찰되었다(Figure 3(b)-3(d)). 이는 주입 후 체온 조건인 37 ℃ 이하에서도 제형이 초기 점탄성 물성을 신속히 회복하여, 안정적인 젤 상태를 유지할 수 있는 가능성을 시사한다. 특히, HGC-CM/TA 써모젤은 다른 제형에 비해 보다 빠르고 안정적인 점탄성 복원력을 나타내었으며, 이는 TA에 의한 물리화학적 가교가 네트워크 안정화 및 회복력 향상에 기여한 것으로 해석된다. 이러한 결과는 해당 써모젤이 생체 내 주입 후 체온 환경(37 ℃)에서도 빠르게 젤화 및 구조 복원을 통해 국소 부위에 안정적으로 고정될 수 있는 가능성을 시사한다.
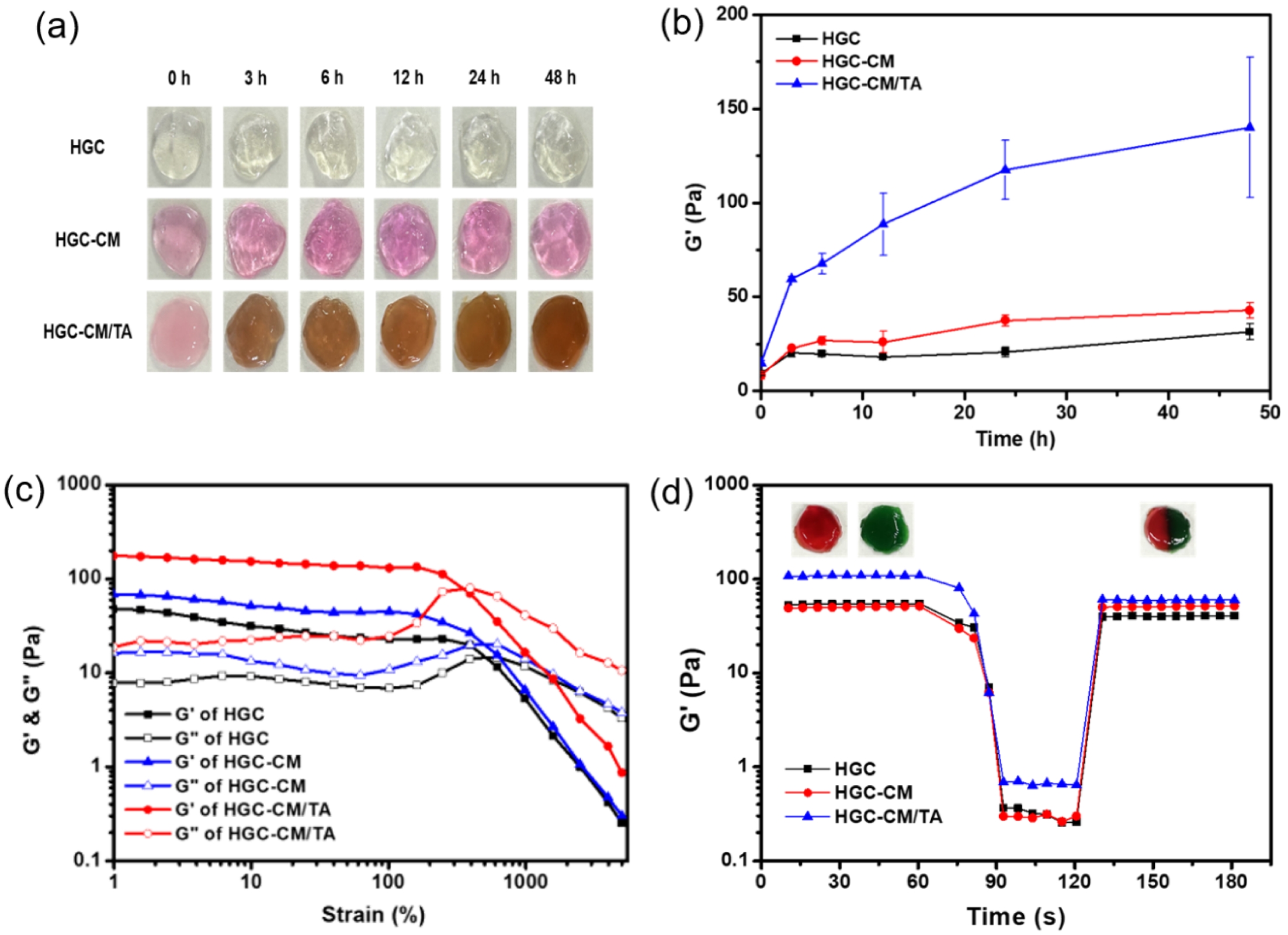
시간에 따른 유변학적 거동 평가. TA가 첨가된 하이드로젤은 공기 중 산화 반응에 의해 TA의 페놀기가 퀴논 구조로 전환되며, 고분자 사슬 간 다양한 물리화학적 결합이 유도된다. 이러한 반응은 네트워크 구조의 치밀화 및 기계적 특성 향상에 직접적인 영향을 미친다. HGC와 HGC-CM 써모젤과는 달리, HGC-CM/TA 써모젤은 시간이 경과함에 따라 진한 갈색으로 변하고 젤의 견고성이 증가하는 것을 확인하였다(Figure 4(a)).
HGC, HGC-CM, 그리고 HGC-CM/TA 써모젤의 시간에 따른 유변학적 특성을 저장 탄성률의 변화로 평가하였다(Figure 4(b)). 모든 제형에서 시간이 지남에 따라 저장 탄성률이 증가하는 경향을 보였으며, 특히 HGC-CM/TA 써모젤은 1시간 이내에 급격한 증가를 나타낸 후, 48시간까지 지속적으로 증가한다. 이는 TA가 산화되어 생성된 퀴논이 써모젤 내에서 다중 결합을 형성함으로써 기계적 강도를 크게 향상시킨 것으로 사료된다. HGC-CM 써모젤은 HGC 써모젤에 비해 다소 높은 G' 값을 나타냈으며 이는 CM 내의 단백질, 사이토카인 등 생리활성 물질이 HGC 사슬과 물리적 상호작용을 통해 좀 더 강한 젤 네트워크 형성을 유도했기 때문으로 판단되며, 구체적으로 CM의 어떤 특정 성분이 어느 방식으로 상호작용을 하는지에 대해서는 추가적인 분석이 필요하다.11 결과적으로 TA의 물리화학적 가교특성에 기반하여 HGC-CM/TA 써모젤은 주입 후 체내 환경에서 보다 향상된 기계적 물성을 확보할 수 있을 뿐 아니라 CM 생리활성 물질을 내부 구조에 보다 안정하게 유지할 수 있을 것으로 사료된다.
자가치유 능력 평가. TA는 다중 페놀기를 포함하고 있어 수소결합, π–π stacking, 금속–리간드 상호작용 등 다양한 비공유 상호작용을 유도함으로서 자가치유 기능을 부여할 수 있는 물질로 알려져 있다. 이러한 TA의 특성을 활용하여 제조한 HGC-CM/TA 써모젤의 자가치유 거동을 유변학적으로 분석하여 그 회복 능력을 평가하였다.
우선, HGC-CM/TA 써모젤의 점탄성 붕괴 거동을 확인하기 위해 strain sweep test를 수행하였다. 변형률을 1.0%에서 5000.0%까지 점진적으로 증가시키며 측정한 결과, 모든 제형에서 저장 탄성률은 변형률이 증가함에 따라 점차 감소하는 경향을 나타내었으며, 일정 변형률 이상에서는 손실 탄성률과 교차하여 젤 구조의 붕괴되기 시작하고 5000.0%의 변형률에서는 완전히 붕괴되었음을 확인할 수 있다. 이후, 자가치유 특성을 평가하기 위해 저변형률(γ=1.0%)과 고변형률(γ=5000.0%) 조건으로 60초 간격으로 반복 적용하는 step-strain sweep test를 진행하였다. 고변형률 조건에서는 G'이 급격히 감소하며 젤 구조가 일시적으로 붕괴되었지만, 저변형률로 전환 시 즉각적으로 G'이 회복되어 초기 탄성 수준에 근접하는 값을 나타냈다. 특히, HGC-CM/TA는 가장 높은 회복률과 응답성을 나타내어 TA가 자가치유 능력 향상에 기여함을 보여준다.
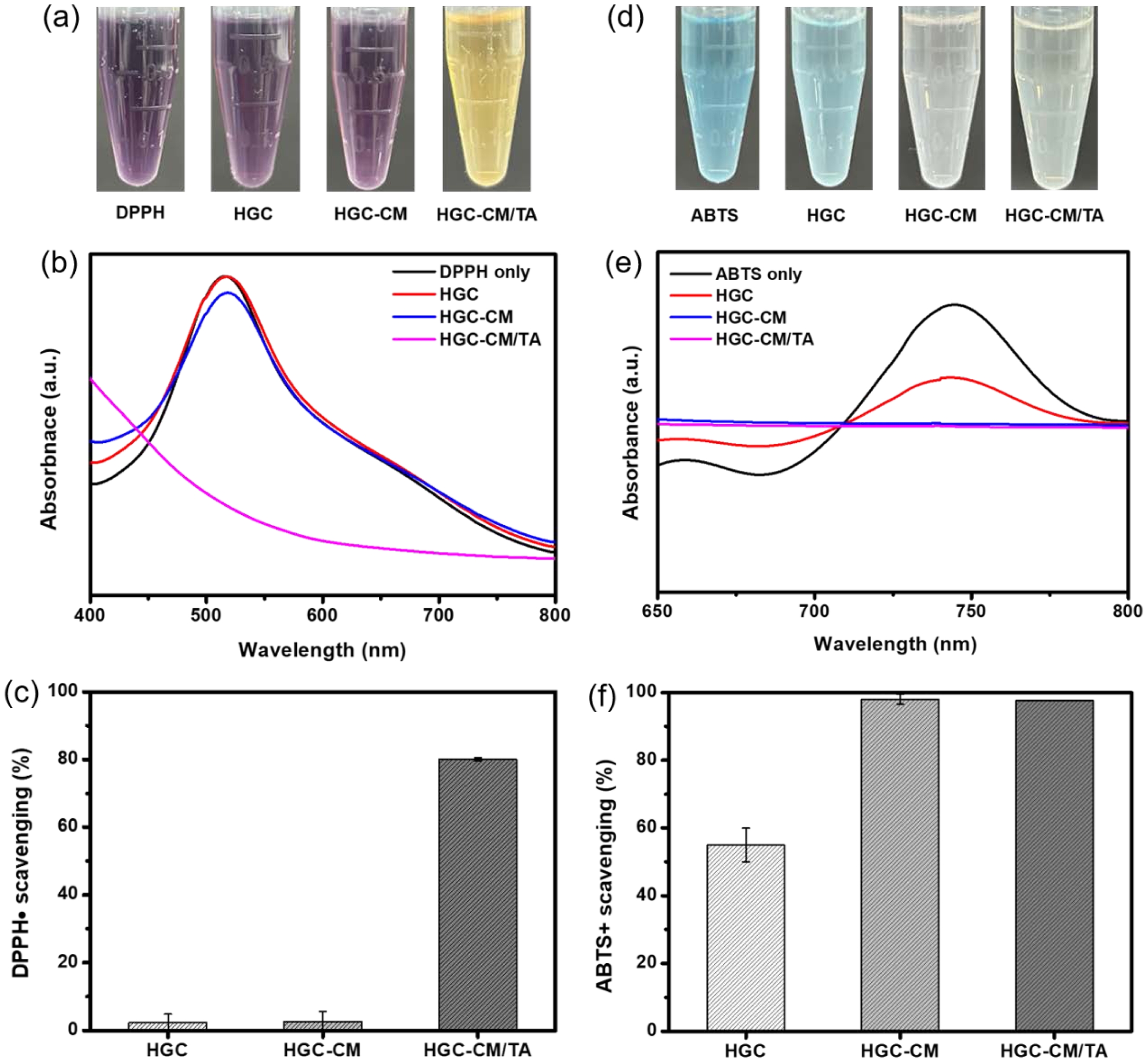
항산화 특성 평가. 써모젤의 항산화 특성을 정량적으로 분석하기 위해 대표적인 자유 라디칼 소거 분석법인 DPPH 및 ABTS 라디칼 소거법을 병행하여 사용하였다. Figure 5(a)-5(c)는 DPPH 라디칼에 대한 써모젤의 소거능을 나타낸다. DPPH 라디칼 용액은 진한 보라색을 띠며, 항산화제에 의해 라디칼이 소거될수록 노란색으로 변한다. HGC와 HGC-CM 써모젤은 517 nm의 파장대에서 DPPH만 존재하는 대조군에 비해 소폭의 흡광도가 나타났으나, HGC-CM/TA 시료에서는 흡광도가 현저히 감소하여 강력한 라디칼 소거활성을 나타냈다. 이러한 항산화 효과는 천연 폴리페놀 화합물인 TA의 도입에 기인한 것으로, TA는 다수의 페놀기를 통해 자유 라디칼과 직접 반응하여 라디칼 연쇄 반응을 억제하는 메커니즘을 가진다.45-47 따라서 HGC-CM/TA 써모젤의 우수한 라디칼 소거능은 TA의 항산화 기능에 기반한 것으로 해석된다.
Figure 5(d, e)는 ABTS 라디칼에 대한 써모젤의 소거능을 나타낸다. ABTS 용액은 청록색을 띠며, 항산화제에 의해 라디칼이 소거될수록 투명해진다. HGC 시료는 약 55%의 ABTS 라디칼 소거 활성을 보인 반면, HGC-CM과 HGC-CM/TA 시료의 경우 각각 100%에 근접하는 높은 소거 활성을 나타내어 탁월한 항산화 효과를 갖는 것으로 확인되었다. 특히, HGC-CM 써모젤의 뛰어난 ABTS 소거 활성은 CM 내 수용성 항산화 인자들의 직접적인 기여에 기인한 것으로 판단된다.48
결과적으로, CM과 TA를 동시에 도입한 HGC-CM/TA 써모젤은 각각의 항산화 기작(수용성/지용성 라디칼 대응)을 통해 상호보완적이고 시너지적인 항산화 효과를 발현하였다.49 이는 조직 재생, 상처 치료 등에서 산화 스트레스를 효과적으로 제어할 수 있는 하이드로젤 플랫폼으로 활용될 수 있는 가능성을 보여준다.
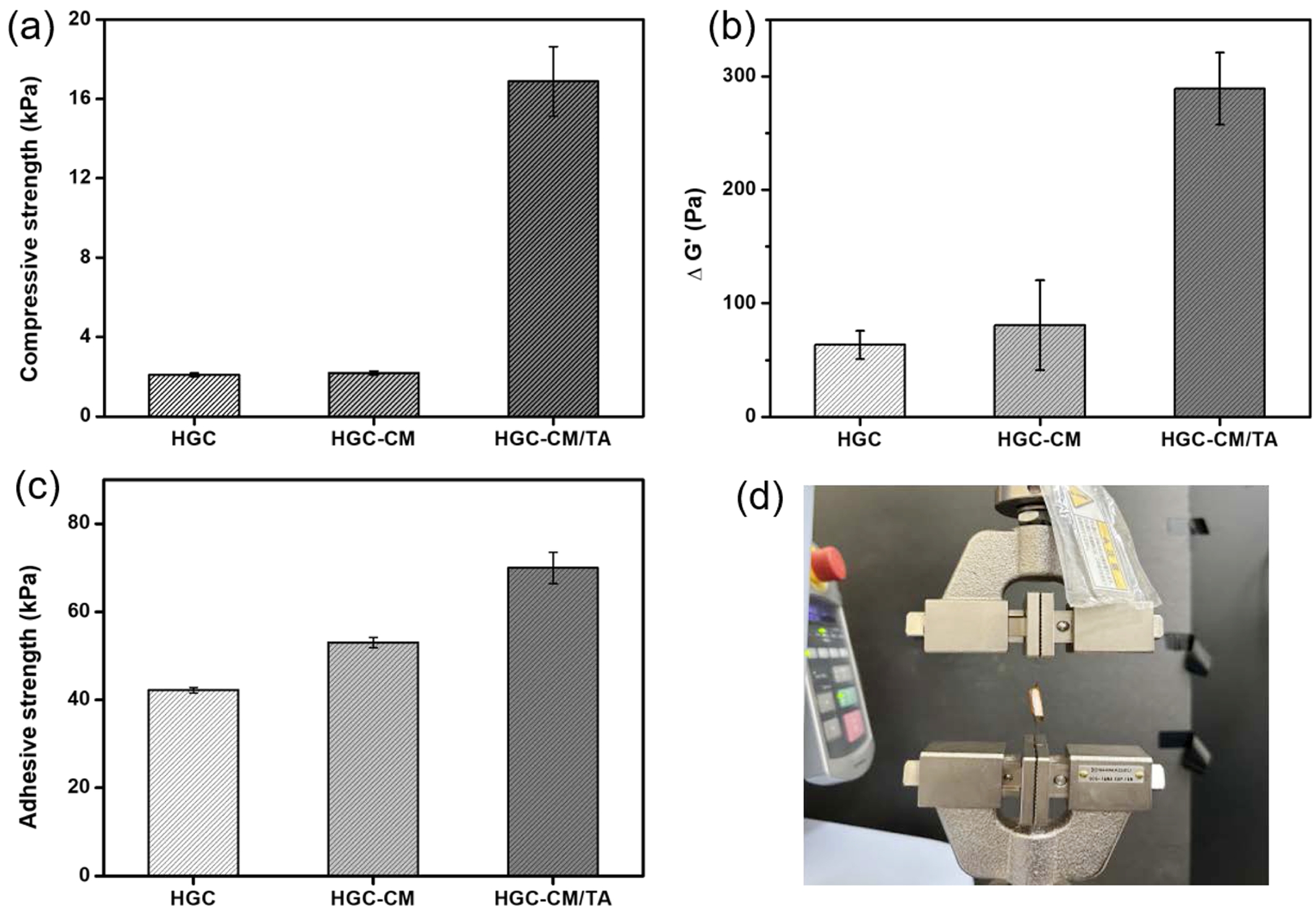
압축강도 평가. 써모젤의 기계적 안정성을 평가하기 위해 압축강도(compressive strength)시험을 수행하였으며, 그 결과를 Figure 6(a)에 제시하였다. HGC-CM/TA 써모젤은 약 20 kPa의 압축강도를 보여, HGC(약 3 kPa) 및 HGC-CM(약 4 kPa)제형에 비해 크게 향상된 기계적 내구성을 나타내었다. 이러한 결과는 TA의 도입에 의한 써모젤의 물리적 네트워크 구조 강화에 기인한 것으로 판단된다. TA는 다수의 페놀성 수산기를 가진 분자로, 써모젤 내의 고분자 사슬 간 수소 결합 및 정전기적 상호작용을 유도함으로써 물리적 결합력을 증가시키고, 결과적으로 써모젤의 기계적 내구성을 높이는 역할을 한다. TA가 도입된 HGC-CM/TA 써모젤은 기존 써모젤에 비해 구조적 안정성이 크게 향상되었으며, 이는 기계적 스트레스가 가해지는 조직 접합부나 조직 지지 환경에서도 효과적으로 활용될 수 있는 생체재료임을 시사한다.
점막 및 조직 접착 특성 평가. 유변학적 분석을 통해 써모젤의 점막부착 특성을 평가하였고, 그 결과를 Figure 6(b)에 나타내었다. HGC, HGC-CM, HGC-CM/TA 모든 써모젤 제형에서 ΔG'가 0보다 양의 값을 나타내는 점막 부착성이 확인되었다. 상대적인 비교에서 HGC-CM이 HGC 단독 써모젤에 비해 점막 부착성이 다소 향상된 것이 관찰된 반면, HGC-CM/TA 써모젤은 다른 HGC와 HGC-CM 써모젤 보다도 월등한 점막부착 특성을 보이는 것으로 나타났다. 이는 TA 성분의 존재가 뮤신과의 다양한 형태의 상호작용으로 써모젤의 점막 부착성을 크게 향상시키는 것으로 사료된다.19,44
돼지 조직을 이용한 조직 접착력 측정 결과(Figure 6(c))에서도 유사한 경향을 보였다. HGC의 경우 약 42.2 kPa, HGC-CM 써모젤의 경우 53 kPa의 접착력을 보인 반면, HGC-CM/TA 써모젤의 접착력은 약 70 kPa으로 크게 향상되었음을 알 수 있었다. 이는 상용 조직 접착제인 피브린 글루(fibrin glue)의 접착 강도(약 9-15 kPa)와 비교할 때, 상대적으로 매우 우수한 접착 성능을 보이는 것으로 나타났다.43 이러한 접착 성능 향상은 써모젤과 생체 조직 사이에서 형성되는 수소 결합, 정전기적 인력, 소수성 상호작용 등 다양한 비공유 결합을 통해 매개된다. 특히, 부가된 TA 성분은 점막 및 조직 표면의 당류나 단백질과 다중 상호작용을 형성함으로써 써모젤의 부착안정성을 크게 향상시킬 수 있는 것으로 사료된다.32,38
결과적으로, HGC-CM/TA 써모젤은 점막 및 조직 표면에 대해 우수한 접착 성능을 보이며, 이는 상처 부위 또는 출혈 부위에 제형이 안정적으로 고정되어 생체 활성 성분의 지속적 방출, 감염 억제, 조직 재생 유도 등에 있어 치료 효율을 높일 수 있을 것으로 기대된다.
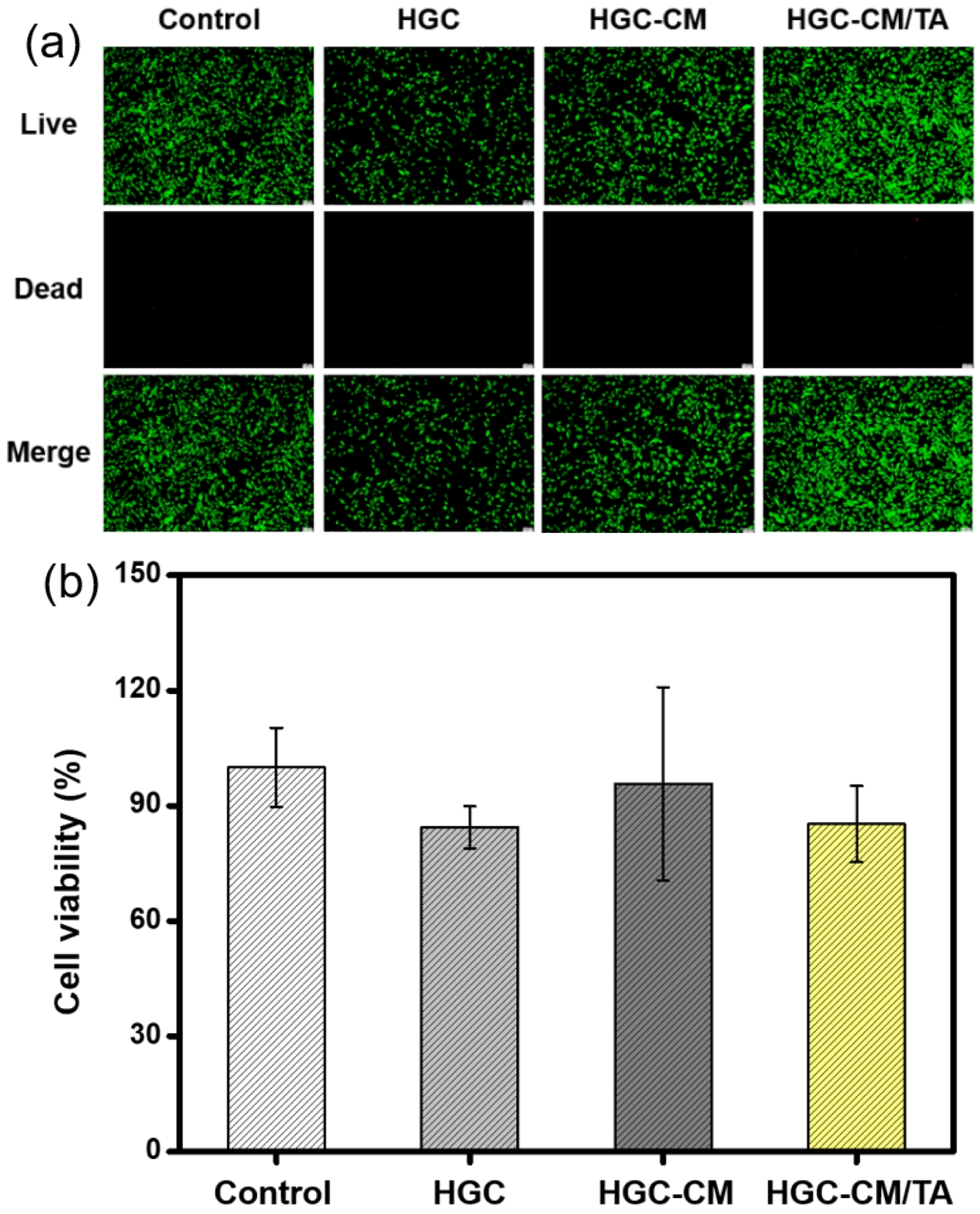
세포독성 평가. HGC, HGC-CM, HGC-CM/TA 써모젤의 용출액 기반의 LIVE/DEAD 염색 및 MTT 분석을 통해 평가하였다(Figure 7). MTT 분석 결과, 모든 실험군의 섬유아세포 생존율은 배지에서 단독 배양한 control group과 유사한 수준으로 유지되었으며, 그룹 간의 유의한 차이는 관찰되지 않았다. LIVE/DEAD 염색 결과에서도 모든 군에서 대부분의 세포가 생존 상태를 유지하였고, 사멸 세포는 드물게 관찰되었다. 또한, 모든 샘플군에서 길게 퍼진 전형적인 섬유아세포 형태를 유지함을 관찰할 수 있었다. 이러한 결과는 HGC-CM/TA 써모젤을 포함한 모든 제형이 세포 독성을 유발하지 않으며, 세포 형태 및 부착에도 부정적인 영향을 유발하지 않았음을 시사한다.
이러한 결과는 해당 써모젤이 세포의 생존과 활성을 유지시키며, 세포독성이 없는 안전한 소재임을 나타낸다. 이러한 생체적합성에 기반하여, HGC-CM/TA 써모젤은 상처 치유 및 피부 조직 재생을 포함한 다양한 바이오 메디컬 응용 분야에 활용될 수 있는 가능성을 보여준다.
|
Figure 2 Thermo-sensitivity of HGC, HGC-CM, and HGC-CM/TA thermogels: (a) photographs showing the thermosensitive sol–gel transition at 25 ℃ and 37 ℃. Temperature-dependent rheological behavior of (b) HGC; (c) HGC-CM; (d) HGC-CM/TA thermogels. |
|
Figure 3 Injectability and recovery behavior of HGC-based thermogels: (a) shear-thinning properties of HGC, HGC-CM, and HGC-CM/TA thermogels at 25 ℃. Thixotropic recovery of (b) HGC; (c) HGC-CM; (d) HGC-CM/TA thermogels. |
|
Figure 4 (a) Time-lapse images; (b) time-dependent changes in storage modulus of the thermogels at 37 ℃; (c) strain sweep test of HGC, HGC-CM, and HGC-CM/TA thermogels at a fixed frequency of 1 Hz and 25 ℃; (d) alternate step strain sweep test from small strain (γ=1.0%) to large strain (γ=5000%) with 60-second intervals at a fixed frequency of 1 Hz and 25 ℃. |
|
Figure 5 Antioxidant properties of the HGC, HGC-CM and HGC-CM/TA thermogels: (a) color change of DPPH solution after reaction with thermogels; (b) UV–vis spectra of the DPPH solutions after a contact time of 30 min with thermogels; (c) DPPH-scavenging activity of thermogels; (d) color change of ABTS solution after reaction with thermogels; (e) UV–vis spectra of the ABTS solutions after a contact time of 30 min with thermogels; (f) ABTS-scavenging activity of thermogels. |
|
Figure 6 (a) Compressive strength of HGC, HGC-CM, and HGC-CM/TA thermogels; (b) mucoadhesive properties of HGC, HGC-CM, and HGC-CM/TA thermogels; (c) the lap shear adhesion strength of HGC, HGC-CM, and HGC-CM/TA thermogels. Each value represents the mean ± standard deviation (n = 3); (d) representative image of the lap shear adhesion test. |
|
Figure 7 In vitro cytotoxicity evaluation of HGC, HGC-CM, and HGC-CM/TA thermogels: (a) live/dead fluorescence images of horse skin fibroblast cells after 48 h incubation with thermogel-extracted media. (Scale bars = 100 μm); (b) quantitative analysis of cell viability assessed by MTT assay following treatment with elutions from each thermogel formulation. |
|
Table 1 Preparation of HGC, HGC-CM and HGC-CM/TA Thermogels |
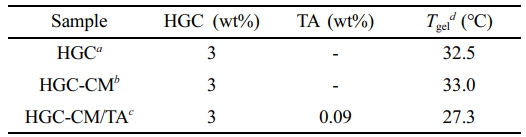
aHGC in DPBS (pH 7.4); bHGC in conditioned media; cMixture solution of HGC and TA in conditioned media; dSol-gel transition temperature was identified through by rheological analysis. |
본 연구에서는 온도감응성 고분자인 HGC을 기반으로, 생리활성이 우수한 태반 유래 중간엽 줄기세포 분비물(CM)과 천연 항산화제인 TA를 도입하여, 물리적 안정성과 생물학적 기능이 향상된 주입형 HGC-CM/TA 써모젤 제형을 개발하였다. 탄닌산은 써모젤 내에서 다양한 물리화학적 가교 유도하여, 기계적 강도, 주입 특성, 자가치유 능력, 점막 및 조직 접착력을 효과적으로 향상시켰으며, 우수한 항산화 활성도 함께 부여하였다. 개발된 HGC-CM/TA 써모젤은 조직공학, 상처치유, 재생의학 등 바이오 의료 응용에 적합한 생기능적 특성을 갖추고 있어, 향후 의료용 주입형 하이드로젤 플랫폼으로서의 활용 가능성이 매우 클 것으로 기대된다.
- 1. Boido, M.; Ghibaudi, M.; Gentile, P.; Favaro, E.; Fusaro, R.; Tonda-Turo, C. Chitosan-based Hydrogel to Support the Paracrine Activity of Mesenchymal Stem Cells in Spinal Cord Injury Treatment. Sci Rep. 2019, 9, 6402.
-

- 2. Saeedi, P.; Nilchiani, L. S.; Zand, B.; Hajimirghasemi, M.; Halabian, R. An Overview of Stem Cells and Cell Products Involved in Trauma Injury. Regen. Ther. 2025, 29, 60-76.
-

- 3. Al‐Jalodi, O.; Kupcella, M.; Breisinger, K.; Serena, T. E. A Multicenter Clinical Trial Evaluating the Durability of Diabetic Foot Ulcer Healing in Ulcers Treated with Topical Oxygen and Standard of Care Versus Standard of Care Alone 1 Year Post Healing. Int. Wound J. 2022, 19, 1838-1842.
-

- 4. Peng, C.; Xu, H.; Zhuang, Q.; Liu, J.; Ding, Y.; Tang, Q.; Wang, Z.; Yao, K. Placenta‐derived Mesenchymal Stem Cells Promote Diabetic Wound Healing via Exosomal Protein Interaction Networks. Wound Repair Regen. 2024, 32, 638-651.
-

- 5. Brown, C.; McKee, C.; Bakshi, S.; Walker, K.; Hakman, E.; Halassy, S.; Svinarich, D.; Dodds, R.; Govind, C. K.; Chaudhry, G. R. Mesenchymal Stem Cells: Cell Therapy and Regeneration Potential. J. Tissue. Eng. Regen. Med. 2019, 13, 1738-1755.
-

- 6. Satija, N. K.; Singh, V. K.; Verma, Y. K.; Gupta, P.; Sharma, S.; Afrin, F.; Sharma, M.; Sharma, P.; Tripathi, R.; Gurudutta, G. Mesenchymal Stem Cell‐based Therapy: A New Paradigm in Regenerative Medicine. J. Cell. Mol. Med. 2009, 13, 4385-4402.
-

- 7. Soleymaninejadian, E.; Pramanik, K.; Samadian, E. Immunomodulatory Properties of Mesenchymal Stem Cells: Cytokines and Factors. Am. J. Reprod. Immunol. 2012, 67, 1-8.
-

- 8. Antoniadou, E.; David, A. L. Placental Stem Cells. Best Pract. Res. Clin. Obstet. Gynaecol. 2016, 31, 13-29.
-

- 9. Moonshi, S. S.; Adelnia, H.; Wu, Y.; Ta, H. T. Placenta‐derived Mesenchymal Stem Cells for Treatment of Diseases: A Clinically Relevant Source. Adv. Therap. 2022, 5, 2200054.
-

- 10. Caplan, A. I.; Correa, D. The MSC: An Injury Drugstore. Cell Stem Cell 2011, 9, 11-15.
-

- 11. Phinney, D. G.; Pittenger, M. F. Concise Review: MSC-Derived Exosomes for Cell-Free Therapy. Stem Cells 2017, 35, 2103-2103.
-

- 12. Vizoso, F. J.; Eiro, N.; Cid, S.; Schneider, J.; Perez-Fernandez, R. Mesenchymal Stem Cell Secretome: Toward Cell-Free Therapeutic Strategies in Regenerative Medicine. Int. J. Mol. Sci. 2017, 18, 1852.
-

- 13. Li, S. Y.; Sun, J. C.; Yang, J. X.; Yang, Y.; Ding, H. F.; Yu, B. Y.; Ma, K.; Chen, M. L. Gelatin Methacryloyl (GelMA) Loaded with Concentrated Hypoxic Pretreated Adipose-derived Mesenchymal Stem Cells (ADSCs) Conditioned Medium Promotes Wound Healing and Vascular Regeneration in Aged Skin. Biomater. Res. 2023, 27, 11.
-

- 14. Nifontova, G.; Safaryan, S.; Khristidis, Y.; Smirnova, O.; Vosough, M.; Shpichka, A.; Timashev, P. Advancing Wound Healing by Hydrogel-based Dressings Loaded With Cell-conditioned Medium: A Systematic Review. Stem Cell Res. Ther. 2024, 15, 371.
-

- 15. Sendon-Lago, J.; Rio, L. G.-d.; Eiro, N.; Diaz-Rodriguez, P.; Avila, L.; Gonzalez, L. O.; Vizoso, F. J.; Perez-Fernandez, R.; Landin, M. Tailored Hydrogels as Delivery Platforms for Conditioned Medium From Mesenchymal Stem Cells in A Model of Acute Colitis in Mice. Pharmaceutics 2021, 13, 1127.
-

- 16. Montero-Vilchez, T.; Sierra-Sánchez, Á.; Sanchez-Diaz, M.; Quiñones-Vico, M. I.; Sanabria-de-la-Torre, R.; Martinez-Lopez, A.; Arias-Santiago, S. Mesenchymal Stromal Cell-conditioned Medium for Skin Diseases: A Systematic Review. Front. Cell. Dev. Biol. 2021, 9, 654210.
-

- 17. Nosrati, H.; Aramideh Khouy, R.; Nosrati, A.; Khodaei, M.; Banitalebi-Dehkordi, M.; Ashrafi-Dehkordi, K.; Sanami, S.; Alizadeh, Z. Nanocomposite Scaffolds for Accelerating Chronic Wound Healing by Enhancing Angiogenesis. J. Nanobiotechnol. 2021, 19, 1.
-

- 18. Jin, R.; Song, G.; Chai, J.; Gou, X.; Yuan, G.; Chen, Z. Effects of Concentrated Growth Factor on Proliferation, Migration, and Differentiation of Human Dental Pulp Stem Cells In Vitro. J. Tissue Eng. 2018, 9, 2041731418817505.
-

- 19. Wang, Z.; Wang, Z.; Lu, W. W.; Zhen, W.; Yang, D.; Peng, S. Novel Biomaterial Strategies for Controlled Growth Factor Delivery for Biomedical Applications. Npg Asia Mater. 2017, 9, e435-e435.
-

- 20. Kim, J. H.; Green, D. S.; Ju, Y. M.; Harrison, M.; Vaughan, J. W.; Atala, A.; Lee, S. J.; Jackson, J. D.; Nykiforuk, C.; Yoo, J. J. Identification and Characterization of Stem Cell Secretome-based Recombinant Proteins for Wound Healing Applications. Front. Bioeng. Biotechnol. 2022, 10, 954682.
-

- 21. Nilforoushzadeh, M. A.; Khodadadi Yazdi, M.; Baradaran Ghavami, S.; Farokhimanesh, S.; Mohammadi Amirabad, L.; Zarrintaj, P.; Saeb, M. R.; Hamblin, M. R.; Zare, M.; Mozafari, M. Mesenchymal Stem Cell Spheroids Embedded in An Injectable Thermosensitive Hydrogel: An In Situ Drug Formation Platform for Accelerated Wound Healing. ACS Biomater. Sci. Eng. 2020, 6, 5096-5109.
-

- 22. Tang, J.; Zhang, P.; Liu, Y.; Hou, D.; Chen, Y.; Cheng, L.; Xue, Y.; Liu, J. Revolutionizing Pressure Ulcer Regeneration: Unleashing the Potential of Extracellular Matrix-derived Temperature-sensitive Injectable Antioxidant Hydrogel for Superior Stem Cell Therapy. Biomaterials 2025, 314, 122880.
-

- 23. Yu, L.; Ding, J. D. Injectable Hydrogels as Unique Biomedical Materials. Chem. Soc. Rev. 2008, 37, 1473-1481.
-

- 24. Lee, K. E.; Choi, D. H.; Joo, C.; Kang, S.-W.; Huh, K. M.; Park, Y. S. Octanoyl Glycol Chitosan Enhances the Proliferation and Differentiation of Tonsil-derived Mesenchymal Stem Cells. Carbohyd. Polym. 2021, 264, 117992.
-

- 25. Mao, W.; Ji, Q.; Chen, P.; Fang, Z.; Li, X. Multifunctional Hydrogel Delivery System for Disease Therapy. Macromol. Res. 2023, 31, 327-338.
-

- 26. Le, T. P.; Jin, S.; Shin, S.-A.; Lyu, A.-R.; Park, Y.-H.; Choi, J. S.; Huh, K. M. Injectable Polyplex-loaded Glycol Chitosan Thermogel for Efficient and Safe Inner Ear Gene Delivery. J. Control. Release 2025, 380, 1095-1108.
-

- 27. Park, S.; Le, T. P.; Byun, H. J.; Lee, S.; Lee, M.; Huh, K. M.; Lee, J. Y. Synergistic Effects of Conductive Hydrogels and Electrical Stimulation in Volumetric Muscle Loss. Chem. Eng. J. 2025, 512, 162362.
-

- 28. Li, Z.; Shim, H.; Cho, M. O.; Cho, I. S.; Lee, J. H.; Kang, S.-W.; Kwon, B.; Huh, K. M. Thermo-sensitive Injectable Glycol Chitosan-based Hydrogel for Treatment of Degenerative Disc Disease. Carbohydr. Polym. 2018, 184, 342-353.
-

- 29. Lee, E. J.; Kang, E.; Kang, S. W.; Huh, K. M. Thermo-irreversible Glycol Chitosan/hyaluronic Acid Blend Hydrogel for Injectable Tissue Engineering. Carbohydr. Polym. 2020, 244, 116432.
-

- 30. Cho, M. O.; Li, Z.; Shim, H. E.; Cho, I. S.; Nurunnabi, M.; Park, H.; Lee, K. Y.; Moon, S. H.; Kim, K. S.; Kang, S. W.; Huh, K. M. Bioinspired Tuning of Glycol Chitosan for 3D Cell Culture. Npg Asia Mater. 2016, 8, e309.
-

- 31. Lin, Z.; Jiang, S.; Ye, X.; Dai, M.; Yang, G.; Liu, L. Antimicrobial Curcumin Nanoparticles Downregulate Joint Inflammation and Improve Osteoarthritis. Macromol. Res. 2023, 31, 1179-1187.
-

- 32. Guo, J.; Sun, W.; Kim, J. P.; Lu, X.; Li, Q.; Lin, M.; Mrowczynski, O.; Rizk, E. B.; Cheng, J.; Qian, G. Development of Tannin-inspired Antimicrobial Bioadhesives. Acta Biomater. 2018, 72, 35-44.
-

- 33. Chen, C.; Yang, H.; Yang, X.; Ma, Q. Tannic Acid: A Crosslinker Leading to Versatile Functional Polymeric Networks: A Review. RSC Adv. 2022, 12, 7689-7711.
-

- 34. Park, S. Y.; Kim, S.; Shin, S. Y.; Cho, W. K.; Huh, K. M. Enhanced Hexanoyl Glycol Chitosan/tannic Acid Thermogels: Customizable Physico-mechanical and Biofunctional Characteristics for Biomedical Applications. Chem. Eng. J. 2024, 493, 152286.
-

- 35. Jafari, H.; Ghaffari-Bohlouli, P.; Niknezhad, S. V.; Abedi, A.; Izadifar, Z.; Mohammadinejad, R.; Varma, R. S.; Shavandi, A. Tannic Acid: A Versatile Polyphenol for Design of Biomedical Hydrogels. J. Mater. Chem. B 2022, 10, 5873-5912.
-

- 36. Xu, J.; Chen, T.-Y.; Tai, C.-H.; Hsu, S.-H. Bioactive Self-healing Hydrogel Based on Tannic Acid Modified Gold Nano-crosslinker as An Injectable Brain Implant for Treating Parkinson’s Disease. Biomater. Res. 2023, 27, 8.
-

- 37. Liu, Z.; Zhang, S.; Ran, Y.; Geng, H.; Gao, F.; Tian, G.; Feng, Z.; Xi, J.; Ye, L.; Su, W. Nanoarchitectonics of Tannic Acid Based Injectable Hydrogel Regulate the Microglial Phenotype to Enhance Neuroplasticity for Poststroke Rehabilitation. Biomater. Res. 2023, 27, 108.
-

- 38. Shin, M.; Kim, K.; Shim, W.; Yang, J. W.; Lee, H. Tannic Acid as a Degradable Mucoadhesive Compound. ACS Biomater. Sci. Eng. 2016, 2, 687-696.
-

- 39. Kim, E. Y.; Lee, E. J.; Kim, R. E.; Kil, T. Y.; Kim, M. K. Evaluation of Stability and Safety of Equine Mesenchymal Stem Cells Derived from Amniotic Fluid for Clinical Application. Front. Vet. Sci. 2024, 11, 1330009.
-

- 40. Park, S. Y.; Kim, S.; Shin, S. Y.; Cho, W. K.; Huh, K. M. Enhanced Hexanoyl Glycol Chitosan/tannic Acid Thermogels: Customizable Physico-mechanical and Biofunctional Characteristics for Biomedical Applications. Chem. Eng. J. 2024, 493, 152286.
-

- 41. Kumar, J.; Purwar, R. Injectable Mesquite Gum and Carboxymethyl Chitosan Hydrogel Using Schiff Base Crosslinks: A Versatile Platform for Drug Delivery in Wound Care. Macromol. Res. 2024, 32, 1237-1254.
-

- 42. Naeem, A.; Yu, C.; Zhu, W.; Chen, X.; Wu, X.; Chen, L.; Zang, Z.; Guan, Y. Gallic Acid-Loaded Sodium Alginate-Based (Polyvinyl Alcohol-Co-Acrylic Acid) Hydrogel Membranes for Cutaneous Wound Healing: Synthesis and Characterization. Molecules 2022, 27,8397.
-

- 43. Park, S. G.; Li, M. X.; Cho, W. K.; Joung, Y. K.; Huh, K. M. Thermosensitive Gallic Acid-conjugated Hexanoyl Glycol Chitosan as a Novel Wound Healing Biomaterial. Carbohydr. Polym. 2021, 260, 117808.
-

- 44. Cho, I. S.; Oh, H. M.; Cho, M. O.; Jang, B. S.; Cho, J. K.; Park, K. H.; Kang, S. W.; Huh, K. M. Synthesis and Characterization of Thiolated Hexanoyl Glycol Chitosan as a Mucoadhesive Thermogelling Polymer. Biomater. Res. 2018, 22, 30.
-

- 45. Hong, K. H. Polyvinyl Alcohol/tannic Acid Hydrogel Prepared by a Freeze-thawing Process for Wound Dressing Applications. Polym. Bull. 2017, 74, 2861-2872.
-

- 46. Azadikhah, F.; Karimi, A. R.; Yousefi, G. H.; Hadizadeh, M. Dual Antioxidant-photosensitizing Hydrogel System: Cross-linking of Chitosan with Tannic Acid for Enhanced Photodynamic Efficacy. Int. J. Biol. Macromol. 2021, 188, 114-125.
-

- 47. Gwak, M. A.; Hong, B. M.; Park, W. H. Hyaluronic Acid/tannic Acid Hydrogel Sunscreen with Excellent Anti-UV, Antioxidant, and Cooling Effects. Int. J. Biol. Macromol. 2021, 191, 918-924.
-

- 48. Saleem, R.; Mohamed-Ahmed, S.; Elnour, R.; Berggreen, E.; Mustafa, K.; Al-Sharabi, N. Conditioned Medium from Bone Marrow Mesenchymal Stem Cells Restored Oxidative Stress-related Impaired Osteogenic Differentiation. Int. J. Mol. Sci. 2021, 22, 13458.
-

- 49. Yamada, S.; Al-Sharabi, N.; Torelli, F.; Volponi, A. A.; Sandven, L.; Ueda, M.; Fristad, I.; Mustafa, K. Harnessing the Antioxidative Potential of Dental Pulp Stem Cell-conditioned Medium in Photopolymerized GelMA Hydrogels. Biomater. Res. 2024, 28, 0084.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2024 Impact Factor : 0.6
- Indexed in SCIE
 This Article
This Article
-
2026; 50(1): 36-48
Published online Jan 25, 2026
- 10.7317/pk.2026.50.1.36
- Received on Jun 9, 2025
- Revised on Sep 6, 2025
- Accepted on Sep 26, 2025
 Services
Services
Shared
 Correspondence to
Correspondence to
- Eun Young Kim** , Min Kyu Kim**, *** , and Kang Moo Huh*, ****
-
**MKbiotech Inc., 99, Daehak-ro, Yuseong-gu, Daejeon 34134, Korea
***Division of Animal and Dairy Science, College of Agriculture and Life Science, Chungnam National University, 99, Daehak-ro, Yuseong-gu, Daejeon 34134, Korea
****Department of Polymer Science and Engineering, Chungnam National University, 99, Daehak-ro, Yuseong-gu, Daejeon 34134, Korea - E-mail: key@mkbiotech.co.kr, kminkyu@cnu.ac.kr, khuh@cnu.ac.kr
- ORCID:
0009-0002-4819-0934, 0000-0001-7099-9735, 0000-000








 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.