- Tailoring Network Structure of Photopolymerizable Gelatin Hydrogels as 3D Cell Culture Scaffolds
Department of Chemical Engineering, Hongik University, Wausanro 94, Mapo-gu, Seoul 04066, Korea
- 3D 세포배양 스캐폴드로 사용하기 위한 광중합성 젤라틴 수화젤의 네트워크 구조 제어
홍익대학교 화학공학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
For 3D cell culture in tissue engineering, the mechanical strength and porous structure of hydrogels as a scaffold have a significant influence on the survival and growth of cultured cells. In this study, the hydrogel was made from gelatin, a biomaterial with excellent biocompatibility, and the mechanical strength and porous structure of the gelatin-containing hydrogel could be controlled by tailoring the network structure of the hydrogel to use the hydrogel as a scaffold. In order to control the network structure of the methacrylate (Gel-MA) hydrogel, the content of the methacrylate groups introduced into the gelatin was changed. As a result, when the content of the methacrylate groups increased, the storage modules of the hydrogel increased but the diffusion coefficient of the hydrogel decreased. These results show that the Gel-MA hydrogels, as scaffolds, with various physical properties suitable for each cell can be synthesized by tailoring the network structure of the hydrogel.
조직공학에서 3D 세포배양을 위한 스캐폴드로 사용되는 수화젤의 기계적 강도와 다공성 구조는 배양세포의 생존 및 생장에 중요한 영향을 미치는 물성들이다. 본 연구에서는 생체적합성이 우수한 생체재료인 젤라틴을 사용하여 수화젤을 제작하고, 이 수화젤을 스캐폴드로 활용함에 있어서 수화젤의 네트워크 구조를 조절함으로써 수화젤의 기계적 강도와 다공성 구조를 제어할 수 있음을 보여주고자 하였다. 메타크릴레이트젤라틴(Gel-MA) 수화젤의 네트워크 구조를 조절하기 위하여 젤라틴에 도입하는 메타크릴레이트 반응기의 함량을 변화시켰고 그 결과, 젤라틴에 도입되는 메타크릴레이트 반응기가 증가함에 따라서 수화젤의 탄성모듈러스는 증가하는 반면, 확산계수는 감소하는 것을 알 수 있었다. 이러한 결과들은 Gel-MA 수화젤의 네트워크 구조를 조절하여 각각의 세포들에 부합하는 다양한 물성을 가지는 Gel-MA 수화젤을 합성하여 스캐폴드로 사용할 수 있음을 보여준다.
Gelatin-containing hydrogels were synthesized by photo-polymerization and the mechanical strength and porous structure of the hydrogel, as a scaffold, could be controlled by tailoring the network structure of the hydrogel. The content of the methacrylate groups introduced into the gelatin was changed to control the network structure of the hydrogel.
Keywords: gelatin methacrylate, hydrogel scaffolds, photo-crosslinking, storage modulus, porosity.
본 연구는 홍익대학교 학술진흥연구비에 의하여 지원되었으며, 이에 진심으로 감사드립니다.
생의학공학과 재생의학 분야에서 고분자 수화젤은 우수한 생체적합성과 높은 수분 함유량 및 다양한 3D 네트워크 구조를 용이하게 성형할 수 있다는 장점으로 3D 세포배양 분야에서 널리 사용되는 스캐폴드들 중 하나이다.1-4 고분자 수화젤이란 다량의 물이나 수성 용매를 흡수할 수 있는 3차원 네트워크 구조를 가진 친수성 고분자로, 수화젤 자체가 가지고 있는 가교구조에 의해 물에 용해되지는 않는다. 고분자 수화젤의 여러 가지 물성들 중 기계적 강도와 다공성(porosity)은 세포 배양 시, 세포의 생존뿐만 아니라 세포의 성장 및 기능에 매우 중요한 요소이기 때문에 수화젤을 스캐폴드로 사용하는 데 있어서 핵심이 되는 물성이라 할 수 있다. 예를 들어, 기계적 강도 측면에서 스캐폴드는 내부에서 생장하는 세포들의 움직임을 지탱할 수 있을 정도로 튼튼해야 하고, 스캐폴드를 이식하는 경우에 처리가 용이할 수 있을 정도로 탄력적이어야 한다. 이와 같이 스캐폴드의 기계적 물성과 세포들의 접착, 증식, 및 분화 사이의 연관성에 대한 많은 연구들이 보고되어 왔다.5-8 또한, 스캐폴드가 가지는 다공성 구조는 배양세포들이 스캐폴드의 공극을 통해 전달받는 산소 및 영양분 등과 직접적인 관련이 있기 때문에 세포조직의 재생 및 발달에 큰 영향을 미칠 수 있다.9-12 이와 같이 세포배양에 중요한 역할을 하는 수화젤 스캐폴드의 기계적 강도와 다공성은 수화젤의 네트워크 구조와 밀접한 연관이 있기 때문에 3D 세포배양에 사용되는 고분자 수화젤을 제작함에 있어서, 수화젤의 네트워크 구조는 중요한 설계 요소들 중 하나이며 이를 반드시 제어할 수 있어야 한다.
젤라틴은 고분자 수화젤의 제조에 널리 사용되는 재료인 콜라겐과 유사한 생체적합성과 생분해성을 보유하면서도 콜라겐에 비해 항원성도 낮고 가격이 현저히 저렴하기 때문에 많은 주목을 받고 있다. 또한, 젤라틴은 Arg-Gly-Asp(RGD) 결합 서열을 포함하고 있어서 스캐폴드 재료로 사용할 경우, 세포가 젤라틴에 직접 결합하여 스캐폴드에 대한 세포 접착력을 향상시키는 장점을 가지고 있다.13-15 젤라틴을 가교구조인 수화젤로 만드는 일반적인 방법은 글루타르알데히드 등의 가교제를 사용하는 것인데, 이 경우 잔존하는 가교제에 의한 세포 독성 문제와 합성된 수화젤의 기계적 강도가 조직공학에서 사용하기에 불충분하다는 문제점이 있다.16-18 따라서 본 연구에서는 생체재료인 젤라틴을 수화젤로 합성하는데 있어서 젤라틴을 중합에 의해 강한 화학적 가교구조를 가지는 수화젤로 합성하려고 한다.
본 연구의 목표는 광중합을 이용하여 젤라틴을 수화젤로 합성하고, 합성된 수화젤의 네트워크 구조를 조절하여 다양한 세포들의 요구에 부합하는 물성을 가지는 젤라틴 수화젤 스캐폴드를 제작하는 것이다. 구체적으로 젤라틴이 중합반응에 참여할 수 있도록 메타크릴레이트 반응기를 젤라틴에 도입한 Gel-MA를 합성하고, Gel-MA를 사용하여 제작하는 Gel-MA 수화젤의 네트워크 구조를 조절하기 위하여 Gel-MA에 도입하는 메타크릴레이트 반응기의 함량을 변화시켰다. 최종적으로 도입된 메타크릴레이트 반응기의 함량에 따른 Gel-MA 수화젤의 팽윤비, 탄성율, 그리고 확산도와 같은 물성을 평가하여 Gel-MA 수화젤 네트워크 구조와 물성들 사이의 상관관계를 조사하였다.
재료. 실험에 사용된 젤라틴(type A, 300 bloom from porcine skin), methacrylic anhydride(MA)과 fluorescein isothiocyanate-dextran(FITC-dextran, 70 kDa)는 Sigma-Aldrich(미국)로부터 구입하였다. Dulbecco’s phosphate buffered saline(DPBS)와 2-hydroxy-1-(4-(hydroxylethoxy)phenyl)-2-methyl-1-propanone (Irgacure 2959)는 GIBCO(미국)와 CIBA Chemicals(미국)로부터 각각 구입하였으며, polydimethylsiloxane(PDMS, Sylgard® 184)는 Dow Corning(미국)으로부터 구입하여 사용하였다.
메타크릴레이트 젤라틴(Gel-MA)의 합성. Gel-MA는 이전에 보고된 방법을 따라 합성하였다.19 간략하게 정리하면, 50 °C에서 DPBS에 젤라틴을 용해하여 10%(w/v) 젤라틴 용액을 제작한 후, 젤라틴에 도입되는 메타크릴레이트(methacrylate) 반응기의 함량을 변화시키기 위해 앞서 제작한 20 mL의 젤라틴 용액에 다양한 양의 MA를 시린지 펌프(NE-300, Just Infusion)를 사용하여 0.5 mL/min의 유속으로 첨가하였다. 이 혼합물을 50 oC에서 3시간 동안 교반하면서 반응시킨 후, 추가로 과량의 DPBS를 첨가하여 반응을 완성하였다. 반응이 완료된 용액을 투석 카세트(10 K MW cut off, Thermo Fisher Scientific, 미국)에 넣고 증류수를 사용하여 7일 동안 세척하였으며, 세척하는 동안 증류수를 매일 교체하였다. 세척이 완료된 용액을 50 mL 튜브에 옮기고 7일 동안 동결건조하여 얻은 최종 Gel-MA는 -80 °C에서 보관하면서 실험에 사용하였다. Gel-MA에 도입된 메타크릴레이트 반응기 함량은 1H NMR(Unity Inova 500 MHz, Varian, 미국)을 사용하여 측정하였다.
Gel-MA 수화젤의 합성. 메타크릴레이트 반응기가 도입된 Gel-MA를 사용하여 광중합에 의해 Gel-MA 수화젤을 합성하였다. 0.3 mL의 DPBS에 0.1 g의 Gel-MA와 광개시제인 Irgacure 2959을 용해하고, 이 용액을 두 장의 유리 슬라이드 사이에 투입한 후, 60초 동안 자외선을 조사하여 시트 형태의 수화젤을 합성하고, 이 수화젤 시트를 직경 1 cm의 디스크 모양으로 절단하여 Gel-MA 수화젤 디스크를 제작하였다.
Gel-MA 수화젤의 팽윤 평가. Gel-MA 수화젤의 네트워크 구조를 거시적으로 평가하기 위하여 수화젤 디스크를 사용하여 팽윤실험을 수행하였다. 건조된 Gel-MA 수화젤 디스크의 중량을 측정한 후, 25 °C DPBS에서 투입하여 팽윤시키고, 24시간 후 팽윤된 디스크를 꺼내서 중량을 조사해서 중량 팽윤비(q)를 계산하였다. q는 팽윤된 수화젤 디스크의 중량을 건조 수화젤 디스크의 중량으로 나누어 계산하였다.
Gel-MA 수화젤의 기계적 물성 평가. Gel-MA 수화젤의 기계적 물성을 조사하기 위해 회전 레오미터(MCR 302, Anton Paar, 오스트리아)를 사용하였다. Gel-MA 수화젤 디스크를 하부 플레이트와 지름 8 mm의 상부 플레이트 사이에 위치하고, 상부 플레이트를 0.5%의 진폭과 0.1에서 100 rad/s의 각속도로 회전시키면서 탄성모듈러스(storage modulus, G' )를 측정하였다. 이 때 상부 플레이트와 하부 플레이트 사이의 간격은 500 μm로 유지하였다.
확산실험용 Gel-MA 수화젤을 포함하는 미세유체 채널의 제작. Gel-MA 수화젤의 다공성 구조를 평가하기 위한 확산실험을 수행하기 위하여 PDMS를 사용하여 Gel-MA 수화젤을 포함한 미세유체 채널을 제작하였다. 미세유체 채널 제작은 직사각형의 PDMS 중앙에 구멍을 만들고, 플라즈마를 이용하여 PDMS의 상단과 하단을 유리 슬라이드로 결합한 후, PDMS의 빈 공간을 Gel-MA와 광개시제를 용해한 DPBS로 채웠다. 이 공간을 직경 1 mm의 투명한 원 모양의 포토마스크로 가리고 자외선을 60초 동안 조사하면 광중합에 의하여 PDMS 채널 내부에 디스크 모양의 Gel-MA 수화젤을 생성할 수 있다. 광중합에 참여하지 않은 미반응물을 제거하기 위해서 마이크로 피펫을 사용하여 미세채널 내부를 DPBS로 여러 번 세척하였다.
Gel-MA 수화젤의 확산거동 평가. Gel-MA 수화젤 네트워크의 확산거동을 평가하기 위해 앞서 제작한 Gel-MA 수화젤을 포함한 미세유체 채널에 100 μL의 FITC-dextran 용액을 주입하고, 시간에 따라서 수화젤 내부와 외부 FITC-dextran의 형광이미지를 촬영하고 ImageJ 소프트웨어를 사용하여 형광세기를 분석하였다. 최종적인 유효 확산계수(Deff)는 실린더 형태에서의 과도 방사상 확산(transient radial diffusion)을 나타내는 식 (1)에 의해서 계산하였다.20
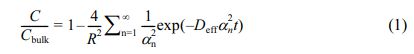
여기서, C는 수화젤 디스크 내부의 형광세기, Cbulk는 수화젤 디스크를 둘러싸고 있는 주변용액의 형광세기, R은 수화젤 디스크의 반지름, Deff는 유효 확산계수, t는 형광세기를 측정한 시간, αn는 제1종, 0차 Bessel함수 J0(αnR)=0의 n번 해이다.
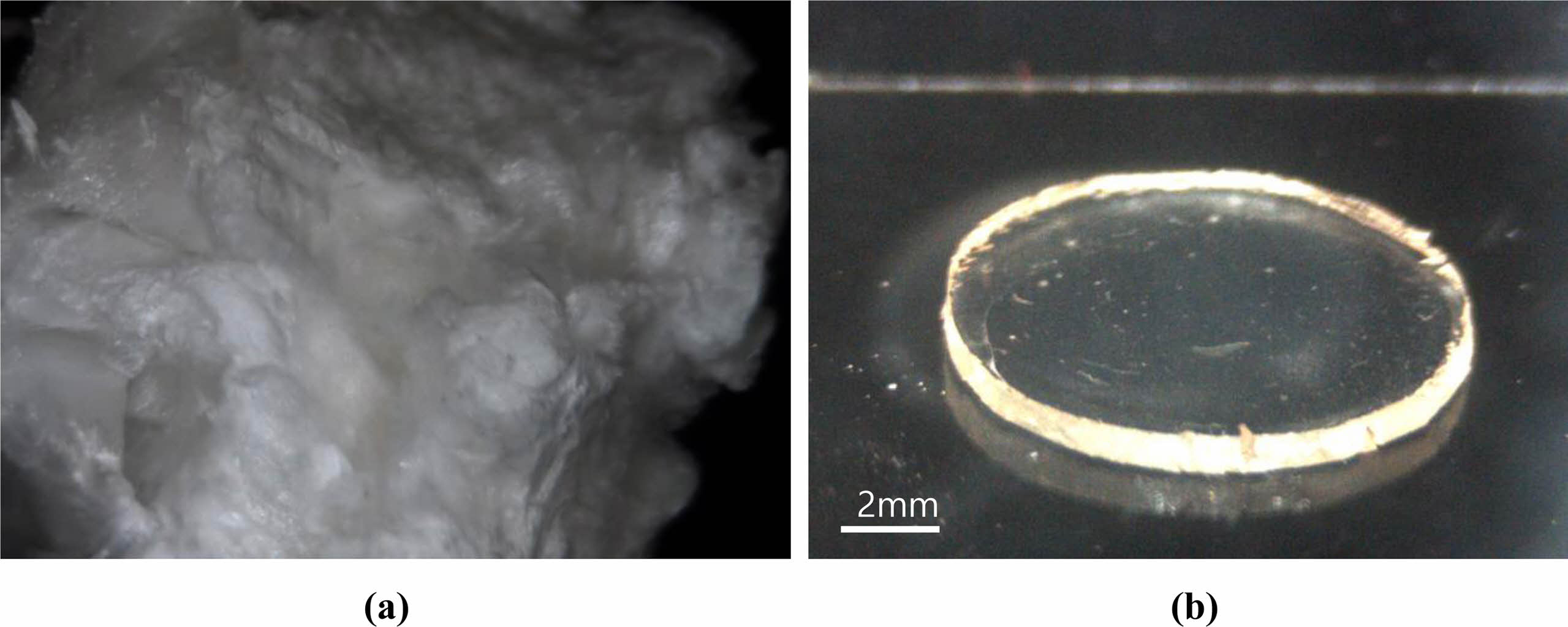
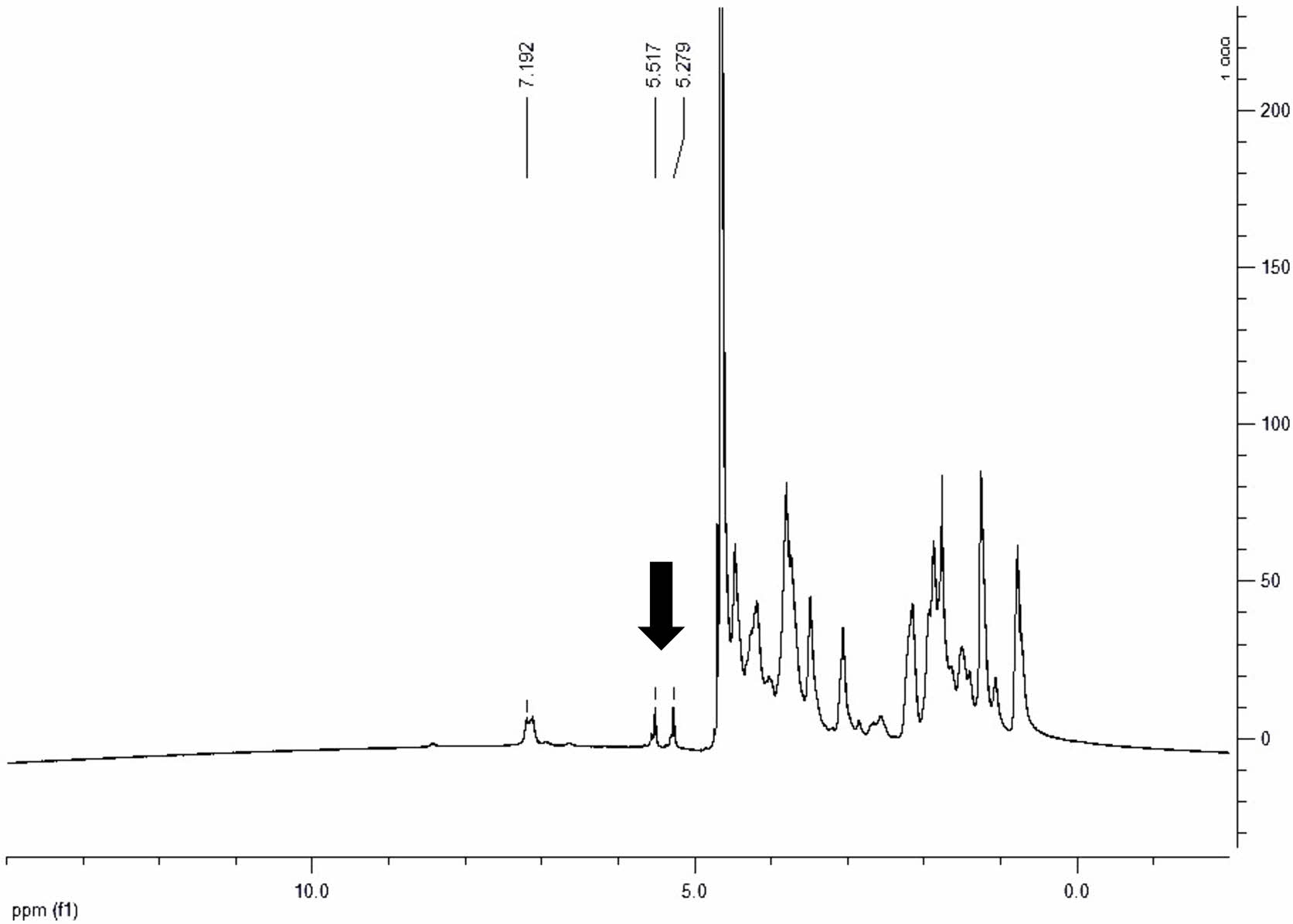
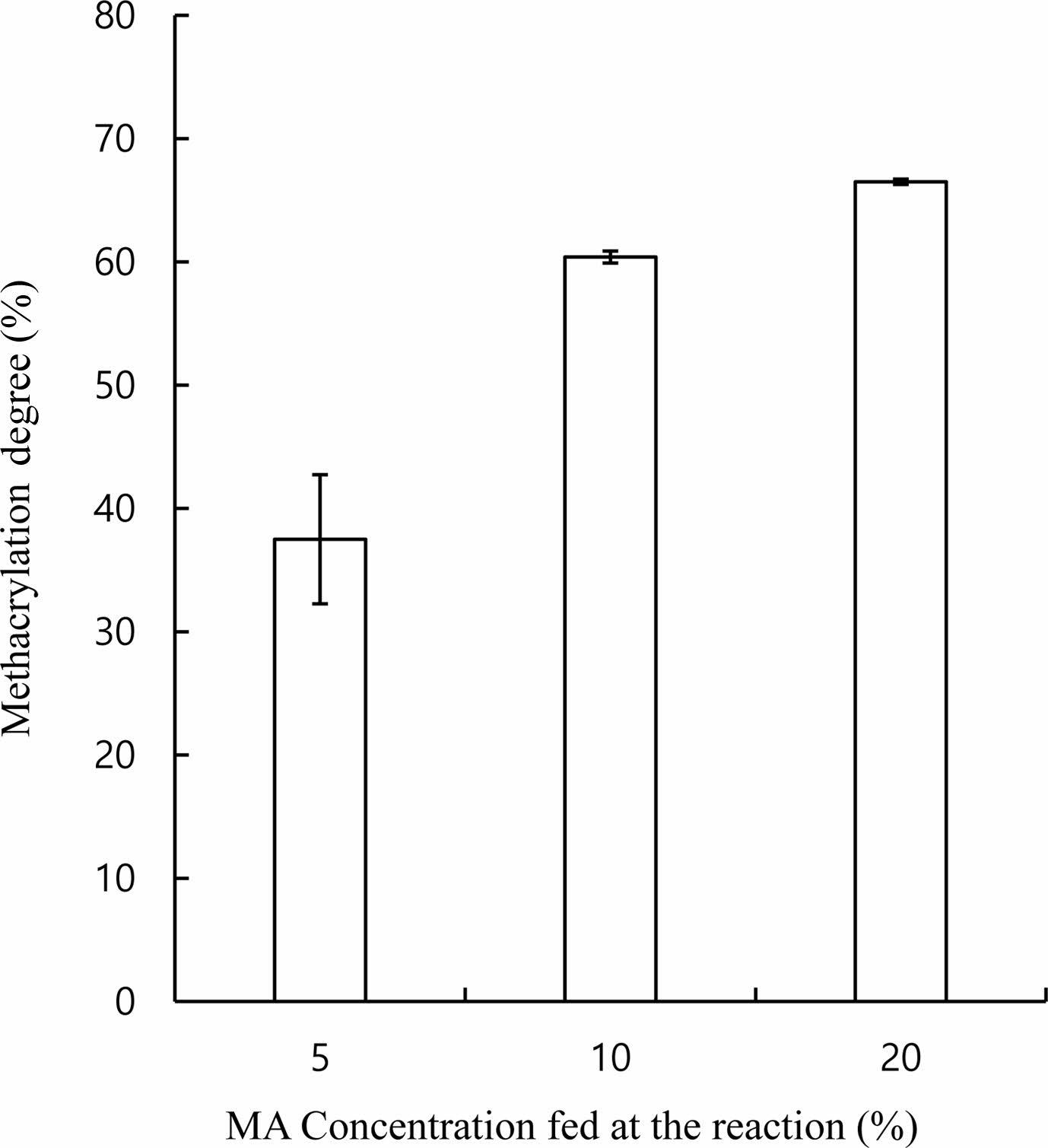
Gel-MA의 합성. Figure 1(a)는 최종 세척 후 일주일 동안 동결건조하여서 얻은 Gel-MA의 사진이다. 합성한 Gel-MA에 중합 반응이 가능한 메타크릴레이트 반응기가 제대로 도입되었는지를 확인하기 위하여 합성한 Gel-MA를 1H NMR을 사용하여 분석하였다. Figure 2의 NMR 결과에서 5.3 및 5.6 ppm에서 보여지는 피크는 메타크릴아미드(mthacrylamide) 이중결합을 나타내는 것으로, 본 실험에서 합성한 Gel-MA에 중합에 의해 젤라틴을 가교시킬 수 있는 메타크릴레이트 반응기가 성공적으로 도입되었음을 나타낸다. 한편, 도입된 메타크릴레이트의 함량은 천연 젤라틴에 존재하는 아민기 수에 대한 젤라틴에 도입된 메타크릴아미드의 수의 비로 계산하였으며, 젤라틴의 방향족 잔기에 해당하는 7.4 ppm에서의 피크와 메타크릴아미드 이중결합에 해당하는 5.3 및 5.6 ppm 피크를 이용하여 계산하였다.21 Figure 3은 Gel-MA 합성 시 첨가한 MA 함량에 따른 Gel-MA에 도입된 메타크릴레이트 정도를 나타낸 결과이다. 반응에 첨가한 MA의 함량이 증가할수록 Gel-MA에 도입된 메타크릴레이트 반응기의 함량이 증가하여서, 20%의 MA를 첨가하였을 경우 약 67%의 젤라틴이 메타크릴레이트화되는 것을 알 수 있었다.
Gel-MA 수화젤의 합성과 기계적 물성. 합성한 Gel-MA를 광개시제의 존재 하에 UV를 조사하면 젤라틴에 도입된 메타크릴레이트 반응기들 사이에 자유라디칼 중합이 진행되어 최종적으로 가교구조를 갖는 Gel-MA 수화젤을 합성할 수 있었다. Figure 1(b)는 광중합으로 만들어진 Gel-MA 수화젤 디스크의 모습을 보여준다.
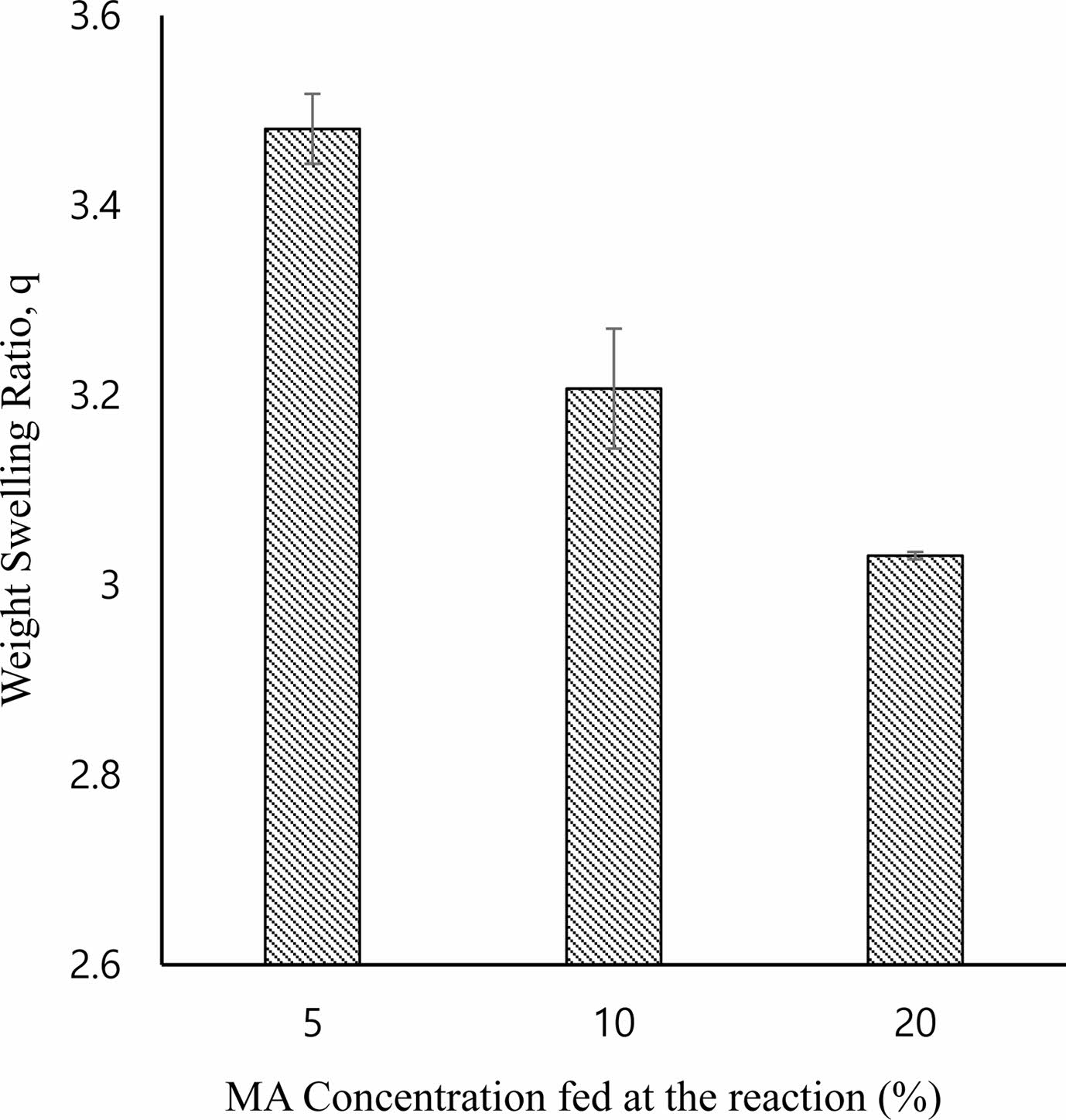
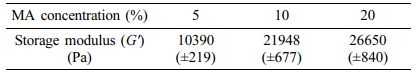
이미 언급한 바와 같이 수화젤의 기계적 강도는 수화젤을 세포지지체로 사용할 경우 세포의 생존 및 성장에 영향을 미치는 중요한 특성이며, 수화젤이 가지는 네트워크 구조와 밀접한 관계가 있으므로, 본 연구에서는 Gel-MA 수화젤의 기계적 특성을 평가하기 위하여 Gel-MA 수화젤의 팽윤거동을 관찰하는 한편, 회전 레오미터를 사용하여 탄성 모듈러스를 측정하였다. Figure 4는 반응에 첨가한 MA 함량에 따른 Gel-MA 수화젤의 중량 팽윤비를 나타낸 결과이다. 수화젤의 팽윤비는 수화젤이 가지고 있는 가교구조를 거시적으로 나타내 주는 것으로 Gel-MA 합성 시 첨가한 MA의 함량이 증가함에 따라서 중합에 의해 가교구조를 형성할 수 있는 메타크릴레이트 반응기가 많아지므로 수화젤의 가교밀도가 증가하여서 팽윤비가 감소하였다. 유변물성 중 탄성모듈러스(G' )는 가교된 수화젤 네트워크의 구조적 정보와 관련이 있기 때문에22 Gel-MA 수화젤의 기계적 강도를 회전 레오미터를 사용하여 유변학적으로 평가하여 보았다. Table 1에 MA 함량에 따른 Gel-MA 수화젤의 탄성모듈러스를 정리하였다. MA 함량을 5%에서 20%로 변화시킴에 따라서 탄성모듈러스가 10390 Pa에서 26650 Pa로 증가하는 것을 볼 수 있다. 이것이 의미하는 바는, 가교구조가 증가함에 따라서 Gel-MA 수화젤이 기계적으로 더 탄성이 강한 물질이 되었다는 것이다. 앞선 팽윤비 실험결과와 탄성모듈러스 실험결과를 종합하면, 젤라틴에 도입되는 중합반응기인 메타크릴레이트 반응기가 증가함에 따라서 중합에 의해 합성된 Gel-MA가 더 조밀한 네트워크 구조로 갖게 되고 그 결과 기계적으로 더 강하고 튼튼한 수화젤이 됨을 알 수 있었다.
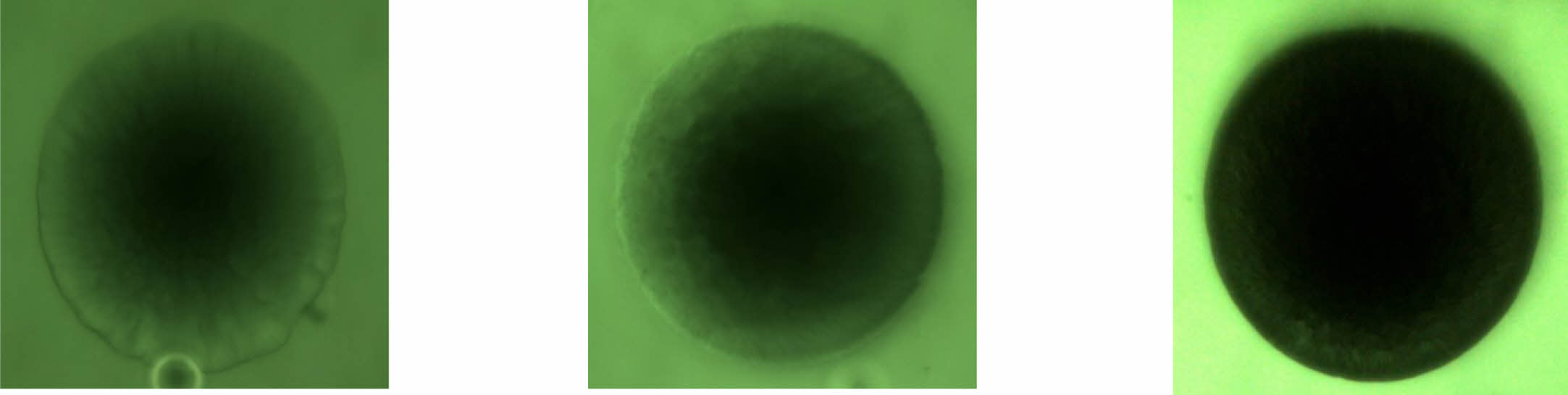
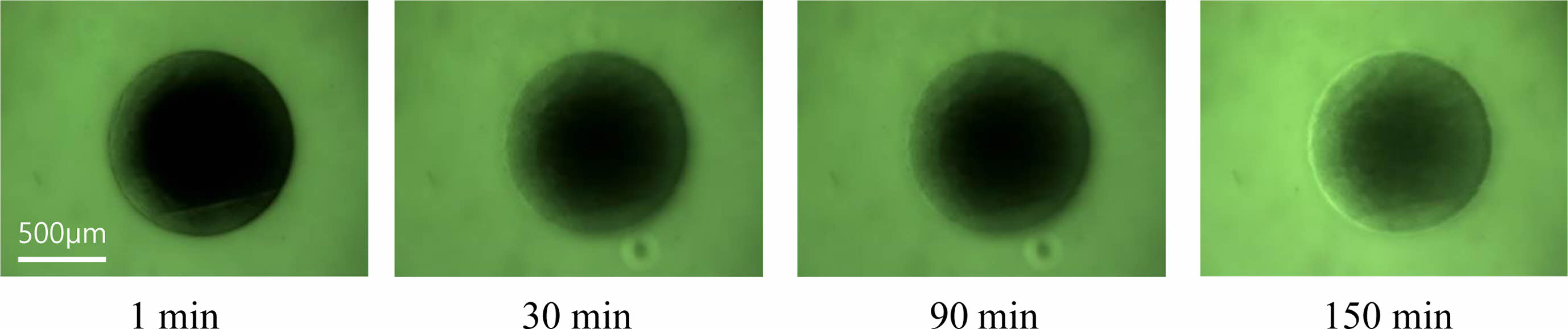
Gel-MA 수화젤의 다공성. 수화젤을 스캐폴드로 사용할 경우, 수화젤의 다공성 구조는 수화젤 내부에서 배양되어지는 세포들에게 필수적인 산소 및 영양소 등을 전달하는 통로로 사용되기 때문에 세포의 성장 및 생존에 매우 중요한 역할을 한다. 따라서 수화젤의 다공성 구조의 제어는 수화젤을 스캐폴드로 활용함에 있어서 매우 중요한 기술이며, 본 연구에서는 Gel-MA 수화젤을 합성함에 있어서 젤라틴에 도입되는 MA 함량에 따른 네트워크 구조의 조절로 Gel-MA 수화젤의 미세다공성 구조를 제어하고자 하였다. Gel-MA 수화젤의 다공성 구조를 평가하는 방법으로는 형광물질이 수화젤 내부로 확산되는 거동을 관찰하는 실험을 수행하였다. Gel-MA 수화젤의 확산실험은 Gel-MA 수화젤을 포함한 미세유체 채널을 제작하고, 형광물질인 FITC-dextran 용액이 수화젤의 외부에서 내부로 침투하는 거동을 관찰하는 것으로, Figure 5는 10%의 MA를 첨가하여 합성한 Gel-MA로 만든 수화젤 외부에 존재하는 FITC-dextran 용액이 Gel-MA 수화젤 내부로 침투하는 거동을 시간에 따라 촬영한 결과이다. 시간이 경과함에 따라서 Gel-MA 수화젤 외부에 있던 FITC-dextran이 수화젤 내부로 침투하여 수화젤의 가장자리부터 점점 중심으로 외부의 FITC-dextran 용액과 같은 색깔로 변하는 것을 볼 수 있었다. ImageJ 소프트웨어를 사용하여 정량화한 형광세기 결과 역시 Gel-MA 수화젤 내부의 FITC-dextran의 형광세기가 시간이 경과함에 따라서 점점 외부에 존재하는 FITC-dextran 용액의 형광세기와 같아지는 것을 알 수 있었다(실험 데이터는 본문에 포함하지 않음).
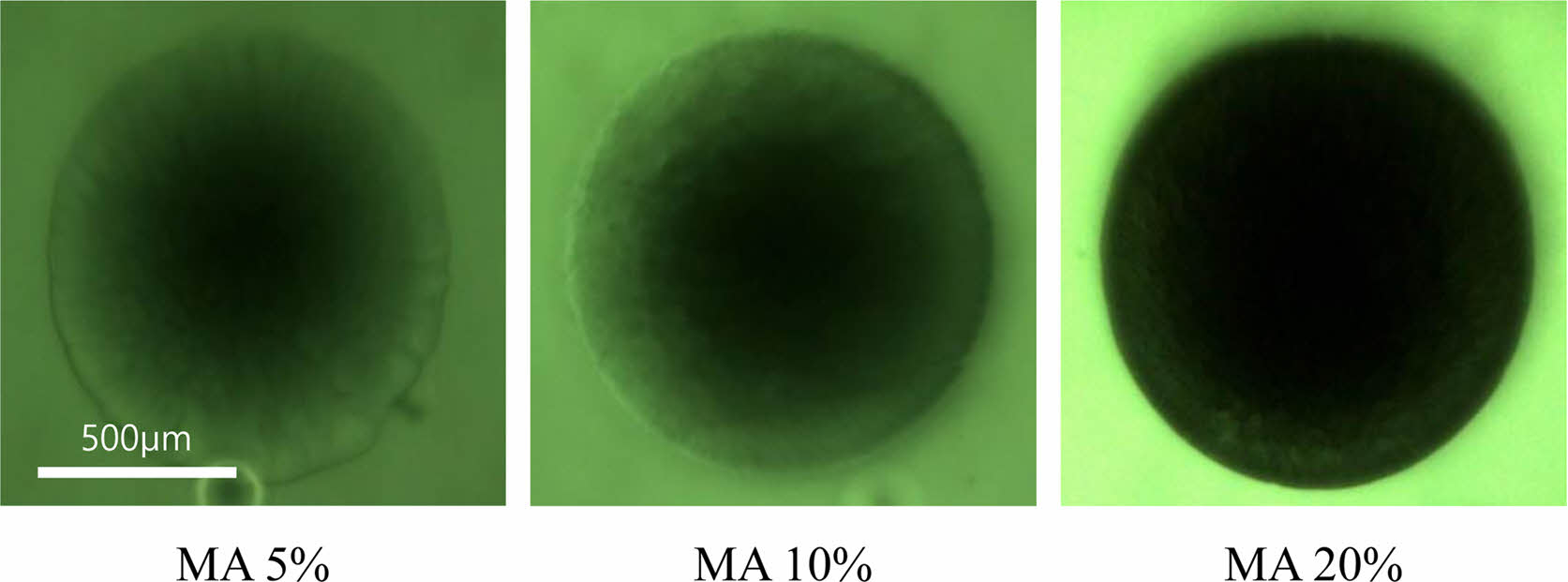
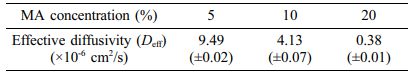
Gel-MA 수화젤의 메타크릴레이트 정도와 수화젤의 다공성 구조의 관계를 조사하기 위하여 다양한 MA 함량(5, 10, 20%)을 첨가하여 합성한 Gel-MA로 만든 수화젤을 사용하여 동일한 시간에 FITC-dextran 용액의 확산거동을 살펴보았다. 그 결과 Figure 6에 나타낸 바와 같이 첨가한 MA 함량이 증가함에 따라서 Gel-MA 수화젤 내부로의 FITC-dextran 용액의 확산이 감소하는 것을 볼 수 있었다. Figure 6는 동일한 시간에 촬영한 Gel-MA 수화젤의 사진들이다. 이러한 결과는 첨가한 MA 함량이 증가함에 따라서 더 조밀한 가교구조를 갖는 Gel-MA 수화젤이 합성되었고, 가교밀도가 증가는 FITC-dextran 용액의 침투를 방해하기 때문에 나타나는 것으로 설명할 수 있다. 확산 결과를 정량화하기 위해서 Gel-MA 수화젤에 대한 FITC-dextran의 유효확산계수(effective diffusivity, Deff)를 식 (1), (2), 그리고 (3)을 사용하여 계산하고, Table 2에 정리하였다. 예상한 바와 같이 MA 첨가량이 증가함에 따라서 유효확산계수가 감소하는 것을 볼 수 있었고, MA 함량을 변화시켜서 0.38×10-6에서 9.49×10-6 cm2/s 범위의 유효확산계수를 갖는 Gel-MA 수화젤을 합성할 수 있었다. 이러한 결과들을 통하여 Gel-MA의 메타크릴레이트 정도를 조절함으로써 다양한 미세 다공성 구조를 가지는 Gel-MA 수화젤들을 합성할 수 있음을 알 수 있었다.
|
Figure 1 Images of (a) foam of the lyophilized Gel-MA; (b) synthesized Gel-MA hydrogel disc by photopolymerization. |
|
Figure 2 1H NMR spectrum of Gel-MA. The peaks at 5.3 ppm and 5.6 ppm show the incorporation of methacrylate groups into gelatin. |
|
Figure 3 Degree of methacrylation of Gel-MA as a function of MA concentration added at the reaction. |
|
Figure 4 welling ratio of Gel-MA hydrogels as a function of MA concentration added at the reaction. |
|
Figure 5 Fluorescence images showing diffusion of FITC-dextran into Gel-MA hydrogels fabricated with 10% of MA concentration over the time. |
|
Figure 6 Fluorescence images showing diffusion of FITC-dextran into Gel-MA hydrogels fabricated with varying MA concentration. The images were taken at the same time (50 min). |
|
Table 1 Storage Modulus (G') of Gel-MA Hydrogels as a Function of MA Concentration |
|
Table 2 Effective Diffusivity of Gel-MA Hydrogels as a Function of MA Concentration |
본 연구에서는 생체재료인 젤라틴에 메타크릴레이트 반응기를 도입한 Gel-MA를 합성하고, 광중합 반응을 이용하여 Gel-MA를 가교구조를 가진 수화젤로 합성하였다. Gel-MA 수화젤을 다양한 세포들의 요구에 부합하는 물성을 가지는 스캐폴드로 활용하고자, 수화젤의 네트워크 구조를 조절하여 다양한 기계적 강도와 다공성 구조를 보유한 Gel-MA 수화젤을 합성하였다. Gel-MA 수화젤의 네트워크 구조를 조절하기 위하여 Gel-MA에 도입하는 메타크릴레이트 반응기의 함량을 변화시켰고, 그 결과, 젤라틴에 도입되는 메타크릴레이트 반응기의 함량이 증가함에 따라서 기계적 강도는 증가하는 반면 확산계수는 감소하는 것을 알 수 있었다. Gel-MA 수화젤의 네트워크의 가교밀도는 수화젤의 기계적 강도뿐만 아니라 다공성 구조에도 영향을 미치는 요소로, 가교밀도가 높을수록 수화젤은 작은 기공크기와 높은 기계적 강도를 갖는다고 이야기할 수 있으며, Gel-MA 수화젤의 가교구조를 조절하여 세포에 큰 영향을 미치는 세포지지체의 기계적 강도와 다공성을 제어할 수 있음을 알 수 있었다.
- 1. Lee, S. H.; Shim, K. Y.; Kim, B.; Sung, J. H. Hydrogel-Based Three-Dimensional Cell Culture for Organ-on-a-Chip Applications. Biotechnol. Prog. 2017, 33, 580-589.
-

- 2. Miller, J. S.; Stevens, K. R.; Yang, M. T.; Baker, B. M.; Nguyen, D. H. T.; Cohen, D. M.; Toro, E.; Chen, A. A.; Galie, P. A.; Yu, X.; Chaturvedi, R.; Bhatia, S. N.; Chen, C. S. Rapid Casting of Patterned Vascular Networks for Perfusable Engineered Three-dimensional Tissues. Nat. Mater. 2012, 11, 768-774.
-

- 3. Peppas, N. A.; Bures, P.; Leobandung, W.; Ichikawa, H. Hydrogels in Pharmaceutical Formulations. Eur. J. Pharm. Biopharm. 2000, 50, 27-46.
- 4. Rosales, A. M.; Anseth, K. S. The Design of Reversible Hydrogels to Capture Extracellular Matrix Dynamics. Nat. Rev. Mater. 2016, 1, 15012.
-

- 5. Tan, Q. G.; Li, S. G.; Ren, J.; Chen, C. Fabrication of Porous Scaffolds with a Controllable Microstructure and Mechanical Properties by Porogen Fusion Technique. Int. J. Mol. Sci. 2011, 12, 890-904.
-

- 6. Pangesty, A. I.; Todo, M. Improvement of Mechanical Strength of Tissue Engineering Scaffold Due to the Temperature Control of Polymer Blend Solution. J. Funct. Biomater. 2021, 12, 47.
-

- 7. Engler, A. J.; Sen, S.; Sweeney, H. L.; Discher, D. E. Matrix Elasticity Directs Stem Cell Lineage Specification. Cell 2006, 126, 677-689.
-

- 8. Discher, D. E.; Janmey, P.; Wang, Y.-L. Tissue Cells Feel and Respond to the Stiffness of Their Substrate. Science 2005, 310, 1139-1143.
-

- 9. Han, S. Y.; Wu, J. Three-dimensional(3D) Scaffolds as Powerful Weapons for Tumor Immunotherapy. Bioact. Mater. 2022, 17, 300-319.
-

- 10. Eckert, R. L.; Rorke, E. A. Molecular Biology of Keratinocyte Differentiation. Environ. Health Perspect. 1989, 80, 109-116.
-

- 11. Annabi, N.; Nichol, J. W.; Zhong, X.; Ji, C.; Koshy, S.; Khademhosseini, A.; Dehghani, F. Controlling the Porosity and Microarchitecture of Hydrogels for Tissue Engineering. Tissue. Eng. Part B Rev. 2010, 16, 371-383.
-

- 12. Wang, H. Y.; Zhou, X. Q.; Wang, J.; Zhang, X. P.; Zhu, M. F.; Wang, H. J. Fabrication of Channeled Scaffolds Through Polyelectrolyte Complex (PEC) Printed Sacrificial Templates for Tissue Formation. Bioact. Mater. 2022, 17, 261-275.
-

- 13. Galis, Z. S.; Khatri, J. J. Matrix Metalloproteinases in Vascular Remodeling and Atherogenesis: The Good, the Bad, and the Ugly. Circ. Res. 2002, 90, 251-262.
-

- 14. Ng, K. W.; Hutmacher, D. W. Reduced Contraction of Skin Equivalent Engineered Using Cell Sheets Cultured in 3D Matrices. Biomaterials 2006, 27, 4591-4598.
-

- 15. Van den Steen, P. E.; Dubois, B.; Nelissen, I.; Rudd, P. M.; Dwek, R. A.; Opdenakker, G. Biochemistry and Molecular Biology of Gelatinase B or Matrix Metalloproteinase-9 (MMP-9). Crit. Rev. Biochem. Mol. Biol. 2002, 37, 375-536.
-

- 16. Zhong, S. Teo, W. E.; Zhu, X.; Beuerman, R.; Ramakrishna, S.; Yung, L. Y. Formation of Collagen-Glycosaminoglycan Blended Nanofibrous Scaffolds and Their Biological Properties. Biomacromolecules 2005, 6, 2998-3004.
-

- 17. Sell, S. A.; Wolfe, P. S.; Garg, K.; McCool, J. M.; Rodriguez, I. A.; Bowlin, G. L. The Use of Natural Polymers in Tissue Engineering: A Focus on Electrospun Extracellular Matrix Analogues. Polymers 2010, 2, 522-553.
-

- 18. Talman, E. A.; Boughner, D. R. Glutaraldehyde Fixation Alters the Internal Shear Properties of Porcine Aortic Heart Valve Tissue. Ann. Thorac. Surg. 1995, 60, S369-S373.
-

- 19. Van den Bulcke, A. I.; Bogdanov, B.; De Rooze, N.; Schacht, E. H.; Cornelissen, M.; Berghmans, H. Structural and Rheological Properties of Methacrylamide Modified Gelatin Hydrogels. Biomacromolecules 2000, 1, 31-38.
-

- 20. Lee, A. G.; Arena, C. P.; Beebe, D. J. Palecek, S. P. Development of Macroporous Poly(ethylene glycol) Hydrogel Arrays within Microfluidic Channels. Biomacromolecules 2010, 11, 3316-3324.
-

- 21. Shin, H.; Olsen, B. D.; Khademhosseini, A. The Mechanical Properties and Cytotoxicity of Cell-laden Double-network Hydrogels Based on Photocrosslinkable Gelatin and Gellan Gum Biomacromolecules. Biomaterials 2012, 33, 3143-3152.
-

- 22. Hwang, J. W.; Noh, S. M.; Kim, B.; Jung, H. W. Gelation and Crosslinking Characteristics of Photopolymerized Poly(ethylene glycol) Hydrogels. J. Appl. Poly. Sci. 2015, 132, 41939.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2022 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2022; 46(6): 793-798
Published online Nov 25, 2022
- 10.7317/pk.2022.46.6.793
- Received on Jul 19, 2022
- Revised on Aug 2, 2022
- Accepted on Aug 10, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Bumsang Kim
-
Department of Chemical Engineering, Hongik University, Wausanro 94, Mapo-gu, Seoul 04066, Korea
- E-mail: bskim@hongik.ac.kr
- ORCID:
0000-0001-7519-168X










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.