- Wound Healing Effect of Gallic Acid-g-Chitosan Gel
Jin Kim*, **, Jae-Young Je***,†
 , and Chang-Moon Lee****, *****, ******,†
, and Chang-Moon Lee****, *****, ******,† 
*Department of Oral and Maxillofacial Surgery, College of Dentistry, Chosun University, Gwangju 61452, Korea
**Institute of Dental Science, Chosun University, Gwangju 61452, Korea
***Division of Smart Healthcare, Pukyong National University, Busan 48513, Korea
****School of Healthcare and Biomedical Engineering, Chonnam National University, Yeosu 59626, Korea
*****Department of Biomedical Engineering, Chonnam National University, Yeosu 59626, Korea
******Research Center of Healthcare and Biomedical Engineering, Chonnam National University, Yeosu 59626, Korea- Gallic Acid가 결합된 키토산 젤의 창상 치유 효과
*조선대학교 구강악안면외과학교실, **조선대학교 치의학연구원, ***부경대학교 스마트헬스케어학부,
****전남대학교 헬스케어메디컬공학부, *****전남대학교 의공학과, ******전남대학교 헬스케어의공학연구소Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
In this study, gallic acid (GA) was conjugated onto chitosan by free radical-mediated covalent binding and the resultant gallic acid-grafted-chitosan (GAC) was prepared in the form of a gel. Compared to the plain chitosan (PC) gel prepared without addition of GA, the wound healing effect of the GAC gel was evaluated in a rat wound model. Both the PC gel and the GAC gel did not show cytotoxicity and the GAC gel effectively inhibited nitric oxide production induced by lipopolysaccharide in RAW264.7 cells. In addition, the GAC gel stimulated more fibroblast migration than the PC gel. In wound model of rats, the GAC gel induced the formation of a normal epidermal layer on the wound site and showed a faster wound healing behavior than the PC gel. These findings suggest that the GAC gel is considered to be useful as a dressing material for wound healing.
본 연구에서는 자유라디칼 매개 공유 결합 형성 방법을 이용하여 gallic acid(GA)를 키토산(chitosan)에 공유 결합하여 제조한 gallic acid-grafted-chitosan(GAC)을 젤(gel) 형태로 제조하여 rat의 창상 모델에서 치유 증진 효과를 평가하였다. 대조구로 GA를 첨가하지 않고 제조한 plain 키토산(PC) 젤을 동일하게 제조하였다. GAC 젤은 PC젤과 유사하게 높은 농도에서 세포독성을 보이지 않았다. GAC 젤은 RAW264.7세포에서 lipopolysaccharide(LPS)에 의해 유도된 nitric oxide(NO)의 생성을 효과적으로 저해하였다. 또한, 섬유아세포의 세포 이동성 평가 결과, GAC 젤은 PC 젤에 비해 세포 이동성을 효과적으로 증진시켰다. Rat의 창상 모델에서 GAC 젤은 창상 부위에 정상 표피층이 잘 형성되도록 유도하였고, PC 젤에 비해 보다 빠른 창상 치유 거동을 보였다. 본 연구를 통해 GA를 첨가하여 제조한 기능성 GAC 젤이 PC 젤에 비해 우수한 NO 생성 저해, 세포 이동성 증진 효과를 통하여 창상부위의 치유를 증진시킨다는 것을 알 수 있었다. 따라서, GAC 젤은 창상 치유를 위한 피복재로써 유용할 것으로 사료된다.
Gallic acid-grafted chitosan (GAC) gel presented in this study provides a moist environment at the wound site. It effectively inhibited nitric oxide production and accelerated fibroblast migration. Therefore, GAC gel is considered to be useful for the recovery of wounds by inhibiting inflammation and enhancing the migration of fibroblast.
Keywords: chitosan, gallic acid, wound healing, cell migration, nitric oxide release.
이 논문은 부경대학교 자율창의학술연구비(2022년) 지원을 받아 수행되었으며 이에 감사드립니다.
저자들은 이해상충이 없음을 선언합니다.
일상생활에서 다양한 원인에 의해 흔하게 발생되는 질병 중의 하나가 피부 결손이다.1 피부의 결손은 1차 면역방어선의 붕괴를 의미하고 바이러스나 세균의 감염에 취약하게 된다.2 피부 결손의 질환은 계속적으로 발생하고 미용이나 웰빙에 대한 관심이 증가함에 따라 피부 결손에 대한 치료제 및 치료법의 개발이 절실히 요구된다.
창상피복재는 상처 난 피부의 오염을 방지하고 보호할 목적뿐 아니라 상처 치유를 촉진하기 위해 사용한다. 현재 사용되는 창상피복재는 부직포형, 필름형, 하이드로젤형, 하이드로콜로이드 패치형 등의 종류가 있다. 창상 치료를 위해서는 상처 부위에 습윤 환경을 유지하고 감염을 방지하는 것이 중요하고 삼출액과 독성 요소를 제거할 수 있어야 한다.3 하이드로젤(hydrogel)은 3차원 망상 구조를 가지고 있고 고분자 사슬 내에 다량의 수분을 함유할 수 있는 특징 때문에 창상피복재로 활용하고 있다. 하이드로젤은 삼출물을 흡수할 수 있고 습윤 환경을 제공할 수 있다. 최근, 합성고분자인 폴리비닐알콜(polyvinyl alcohol), 폴리에틸렌(polyethylene), 폴리카프로락톤(polycaprolactone)과 천연고분자인 키토산(chitosan), 알지네이트(alginate), 셀룰로오스(cellulose), 콜라겐(collagen), 젤라틴(gelatin) 등이 하이드로젤형 창상피복재로 사용되고 있다.4-9
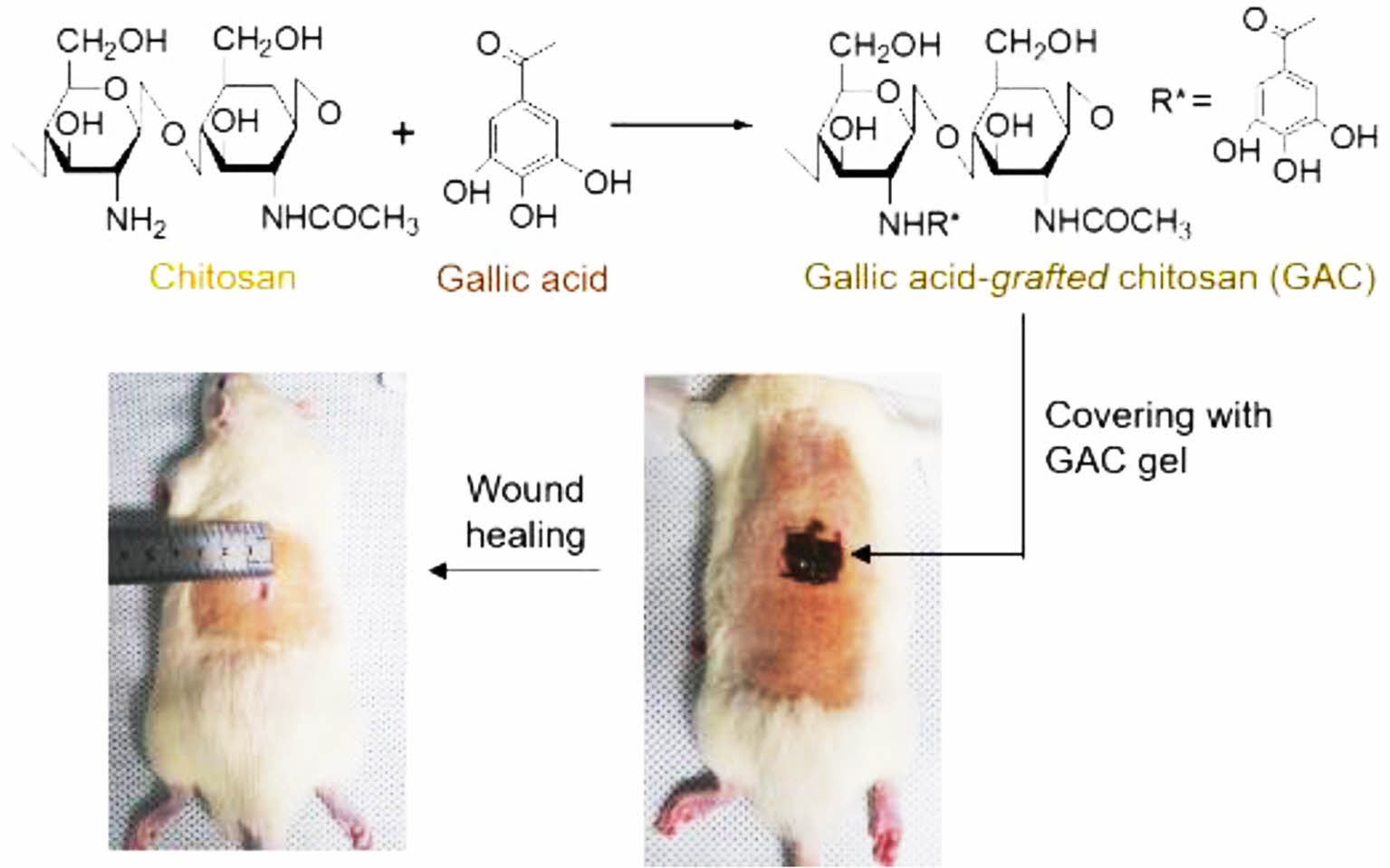
키토산은 효소에 의해 분해되는 특징을 가지고 있으며 생체적합성과 혈액적합성이 우수하기 때문에 상처 치료용 드레싱, 항응혈제, 약물전달체 등에 널리 활용되고 있다. 새우나 게와 같은 갑각류의 껍질로부터 추출하여 얻는 키틴(chitin, β-1,4-2-acetamide-2-deoxy-D-glucose)을 탈아세틸화(deacetylation)하여 키토산을 제조한다. 최근 키토산의 주사슬(main chain)에 gallic acid, caffeic acid, ferulic acid와 salicylic acid 등과 같은 폴리페놀(polyphenol)을 결합하여 항산화 와 항염효과를 증진시킬 수 있어서 식품, 의약품 및 화장품 분야에 널리 응용하고 있다.10-12 Gallic acid의 항알레르기, 항염효과와 항암활성을 활용한 연구가 활발하게 진행되고 있다. 예를 들어, da Rosa등은 항산화 활성을 향상시키기 위해 gallic acid가 함유된 키토산을 동결건조하여 활용하였고 gallic acid가 함유된 키틴 하이드로젤을 이용하여 상처 치유 효과 및 항암 활성 연구결과를 보고하였다.13 키토산에 gallic acid를 화학적으로 결합하여 연구한 결과는 많이 보고 되고 있으나 하이드로젤 창상피복재의 기능을 향상시키기 위해 키토산에 gallic acid를 도입하는 연구는 보고되지 않고 있다.14,15 따라서, 본 연구에서는 키토산에 gallic acid를 화학적으로 공유결합하고 하이드로젤 필름 형태로 제조하여 세포독성, 세포의 이동성과 렛(rat) 창상 모델에서 상처 치유 효과를 평가하였다(Figure 1).
|
Figure 1 Schematic illustration for evaluating wound healing effect of gallic acid-grafted-chitosan (GAC) gel in wound model of rats |
재료. 키토산(평균분자량: 310 kDa, 탈아세틸화도: 90%)은 키토라이프(서울, 한국)에서 구입하였다. Gallic acid, Folin-Ciocalteu’s 시약 및 ascorbic acid는 Sigma Chemical 社(St. Louis, MO, USA)에서 구입하였다. 그 외 나머지 시약은 실험용 특급 시약을 사용하였다.
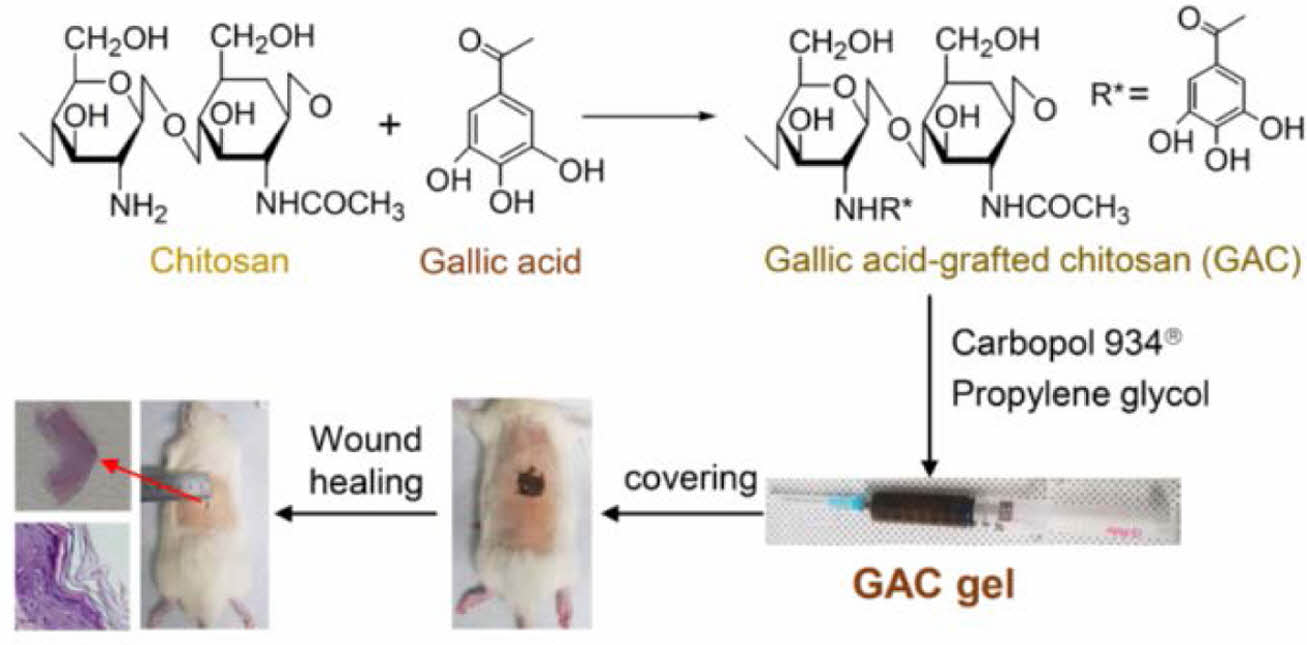
Gallic Acid-grafted-Chitosan(GAC) 제조. GAC는 제조는 본 연구팀에서 보고한 방법에 따라 시행하였다.16 즉, 0.5 g 키토산을 2% 아세트산 용액 50 mL에 완전히 녹인 다음 0.054 g의 ascorbic acid가 포함되어 있는 1.0 M H2O2 용액 1 mL를 첨가하여 30분 동안 상온에서 반응시켰다. Gallic acid를 키토산 잔기에 1:1 몰비율로 첨가한 후 24시간 동안 반응시킨 다음 투석막(1000 Da)을 사용하여 반응하지 않은 gallic acid는 모두 제거하였다. Gallic acid를 첨가하지 않는 대조군(plain chitosan, PC)도 동일한 과정으로 제조하였다.
GAC의 합성 확인. 제조한 PC 및 GAC는 1H NMR(400 MHz, JNM ECZ-400, JEOL, Tokyo, Japan), Fourier-transform infrared(FTIR, JASCO Inc. Tokyo, Japan), UV-VIS(MultiskanTM GO UV-Vis microplate spectrometer, Thermo Scientific, Waltham, MA, USA)를 이용하여 분석하였다.
GAC 젤 제조. 제조한 GAC를 기반으로 한 도포형 젤의 제조는 기존 연구에 사용된 방법을 변형하여 제조하였다.17 GAC(100 mg), 점증제 carbopol 934®(0.2 g), 보습제 propylene glycol(0.2 g), ethanol(5 mL)과 pH 조절제 triethanolamine (200 μL)을 증류수에 용해한 후 총량을 100 mL로 맞춘 후 호모게나이저를 이용하여 충분히 혼합시켜 도포가 가능한 타입의 젤을 제조하였다.
세포독성평가. 제조한 GAC 젤의 세포독성은 MTT assay를 이용하여 평가하였다. MTT assay를 수행하기 위해 GAC 젤의 용출액을 제조하였다. GAC 젤 100 mg을 10 mL DMEM에 담근 후 37°C에서 24시간 동안 용출한 용액을 실험에 사용하였다. 정상 세포인 RAW264.7 세포(Korea Cell Line Bank, KCLB, No. 40071, 1×105 cell/wll)를 96 well plate에 분주하고 24시간 동안 배양한 후 배지를 제거하였다. GAC 젤의 용출물을 배지와 혼합하여 100, 250, 500, 그리고 1000 μg/mL의 농도로 맞춘 후 200 μL씩 well에 넣어서 48시간 배양하였다. 배양 완료 후 배지를 제거하고 각각의 well에 5 μL MTT용액(5 mg/mL in PBS)을 첨가하였다. 4시간 배양 후에 100 μL DMSO를 첨가하고 microplate reader (ELX800, Biotek Instruments, VT, USA)를 이용하여 570 nm에서 흡광도를 측정하여 세포생존률을 평가하였다.
염증 활성 저해 평가. GAC 젤의 용출액이 세포의 NO 생성을 저해하는 효과가 있는지 평가하기 위해 RAW264.7 세포(5×104 cell/well)를 96 well plate에 분주하고 12시간 배양하였다. GAC 젤의 용출물을 배지와 혼합하여 100, 250, 500, 그리고 1000 μg/mL의 농도로 맞춘 후 200 μL/well을 첨가하였다. 배양 1시간 후 LPS(1 μg/mL)를 각 well에 첨가하여 24시간 동안 배양하였다. 배지의 상등액(100 μL)을 취한 후 동량의 Griess reagent(100 μL)를 넣어 총량이 200 μL 되도록 맞추고 상온에서 10분간 반응시켰다. RAW264.7 세포가 생성하는 NO의 양은 microplate reader를 이용하여 540 nm에서 흡광도를 측정하여 평가하였다.
세포 이동성 평가. GAC 젤이 세포 이동에 미치는 영향을 평가하기 위해 세포를 단층으로 배양한 후 scratch를 가해 빈 공간을 만들고 GAC 용출액을 처리하여 세포의 증식을 관찰하였다. NIH 3T3 섬유아세포(fibroblast, 5×104 cell/well)를 48 well plate에 분주하고 5% CO2 배양기에서 24시간 배양하였다. 형성된 세포 단층에 200 μL pipet tip으로 scratch를 가해 빈 공간을 만들고 용출물을 200 μL를 처리한 후 24시간 배양하고 세포의 증식 및 이동 정도를 현미경을 이용해 빈 공간의 간격을 측정하여 대조군과 비교하였다.
동물실험. 본 연구에서 실시한 동물실험은 조선대학교의 동물실험 윤리위원회의 사전승인 이후 설치류 사육실에서 조선대학교의 표준 작업지침에 따라 수행하였다. SD rat (Female, 300-350 g)을 24시간 동안 절식시켰고, 창상을 유발하기 위해 졸레틸과 럼푼을 1:2 비율로 혼합하여 근육주사 하였다. 마취를 확인하고 전기제모기로 rat의 등 부위 털을 제거하였다. 등 부위에 10% povidine-iodine과 70% 에탄올을 각각 도포하여 소독한 뒤 가로세로 각각 2 cm×2 cm의 크기로 진피층을 포함한 전층 결손 창상을 유발하였다. 생리식염수만 창상부위에 처리한 그룹, PC가 함유된 젤을 창상부위에 처리한 그룹, GAC 젤을 창상부위에 처리한 그룹으로 나누어 창상치유 효과를 평가하였다. 창상부위 위에 멸균된 3M 테가덤(Tegaderm®, 3M Healthcare, USA)를 덮고 그 위에 탄력밴드 (Coban®, 3M Healthcare, USA)로 움직임에 지장이 없도록 감아주었다. 상처치료의 진행 과정을 관찰하기 위해 창상 유발 시작부터 3, 7, 14, 21일에 digital camera (CAMEDIATM, Olympus Co., Tokyo, Japan)를 이용하여 정해진 일정거리에서 촬영하여 상처 변화를 관찰하였다. 객관적인 지표로 나타내기 위하여 ImageJ(NIH, USA) 프로그램을 활용하여 창상의 면적을 비교하였다.
통계처리. 실험결과는 평균±표준편차로 표기하였고, 통계적 유의성은 Student’s t-test로 판별하였다. 통계적 유의성은 p<0.05의 값으로 설정하였다.
GAC 특성 분석. GAC의 제조는 본 연구팀에서 보고한 방법에 따라 제조한 다음 1H NMR, FTIR, UV-VIS를 이용하여 합성 성공 여부를 이전 논문에 보고하였다.16,18 이전 논문에서 보고한 1H NMR 결과, GAC에서는 PC와 비교하여 7.04 ppm에서 새로운 피크가 관찰되었는데 이것은 gallic acid의 방향족 수소에 의한 것이고 나머지 피크들은 PC와 마찬가지로 전형적인 키토산 피크로 확인되었다. FTIR 분석에서는 gallic acid의 결합으로 인한 새로운 C=O 흡수밴드가 PC의 amide I과 동일한 부근에서 겹쳐서 나타났다. UV-VIS 스펙트럼에서는 PC의 경우 200에서 500 nm가지 어떠한 흡수 피크도 나타나지 않았으나 gallic acid는 208 및 258 nm에서 흡수 피크가 관찰되었으며 GAC의 경우에는 258 nm 피크가 265 nm로 이동된 것을 확인할 수 있었는데 이것은 gallic acid가 PC에 공유결합에 의한 것으로 확인된다. GAC에 결합한 gallic acid의 함량을 측정한 결과 111 mg gallic acid/g GAC로 측정되었다.
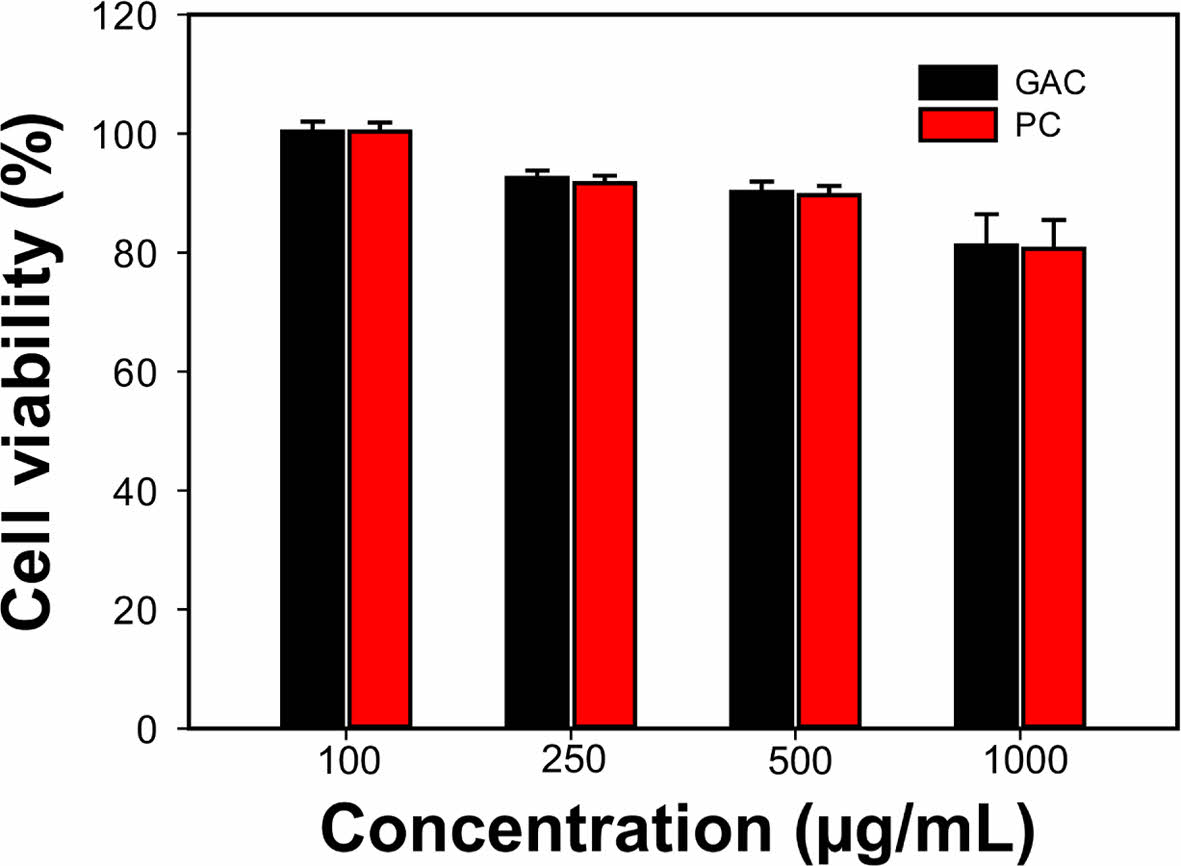
GAC 젤의 세포독성 평가. GAC 젤의 세포독성을 평가하기 위해 국제표준화기구 기준(ISO 10993)의 시험방법으로 평가하였다. GAC 젤의 용출물을 RAW264.7 세포에 처리하고 세포의 생존율을 MTT 분석법으로 조사하여 독성 여부를 확인하였다. Figure 2에서 볼 수 있듯이, GAC 젤 500 μg/mL의 용출물을 처리한 후 RAW264.7 세포는 90.2±1.7%의 생존율을 보였고, 1000 μg/mL의 용출물을 처리했을 때 81.2±5.2%의 생존율을 보였다. 반면에 PC 젤 500 μg/mL의 용출물을 처리한 후 RAW264.7는 89.7±1.7%의 생존율을 보였고 1000 μg/mL의 용출물을 처리했을 때 80.7±4.8%의 생존율을 보였다. PC 젤과 GAC 젤의 용출물의 모든 처리 농도에서 세포생존률은 80% 이상을 보여 두 시료는 처리 농도에서 세포독성을 나타내지 않는다고 판단되었다. Gallic acid와 키토산은 세포에서 독성을 보이지 않는다고 잘 알려져 있다.19,20 최근에 Kaparekar 등은 gallic acid가 함유된 키토산 나노입자를 제조하고 창상 부위에 적용하여 치료효과를 평가하였다.21 Kaparekar 등의 연구에서 볼 수 있듯이 gallic acid를 함유한 키토산 나노입자는 고농도(20 mg/L)에서 NIH3T3세포에서 독성을 보이지 않았다.
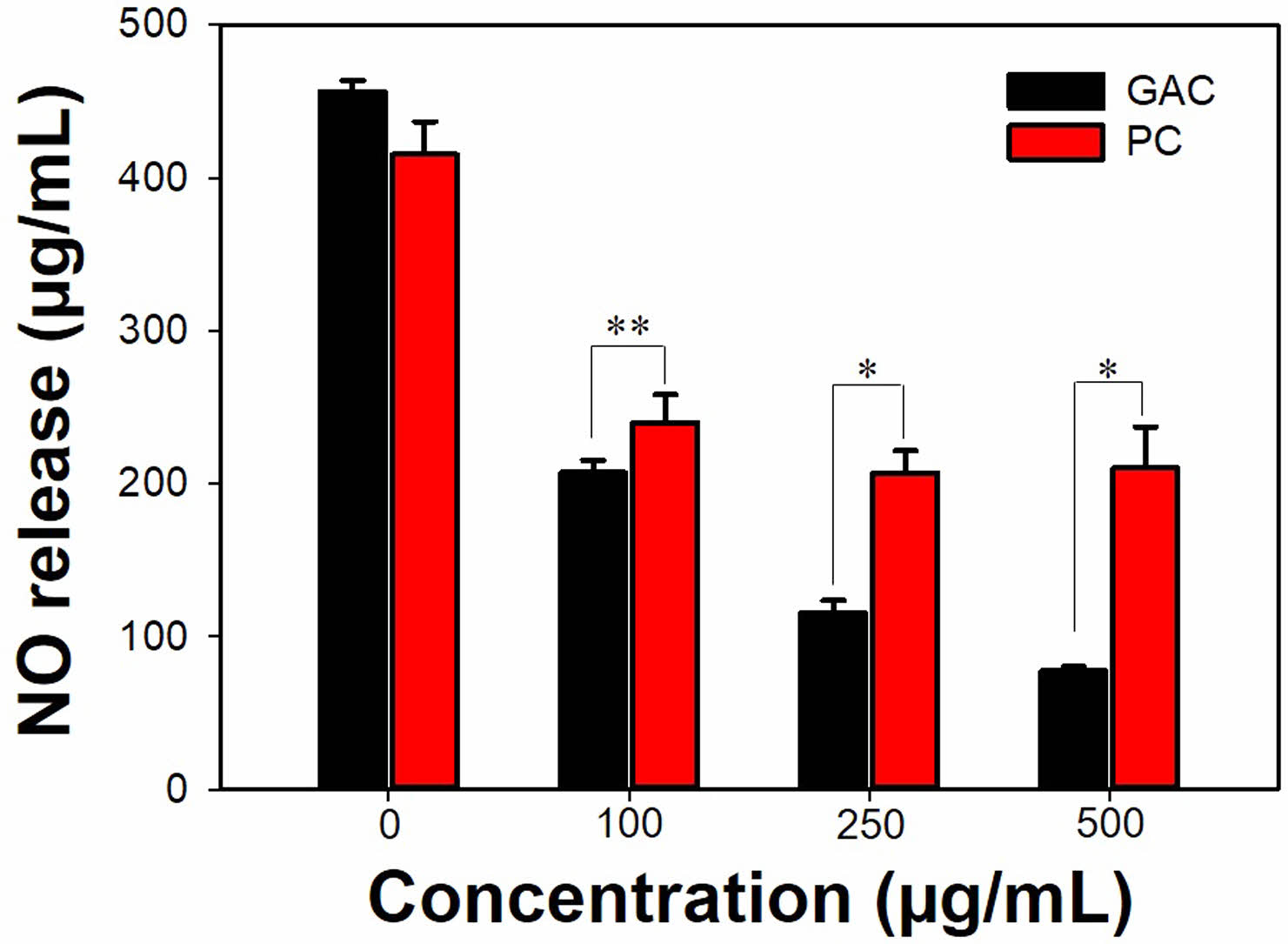
Nitric Oxide 생성 저해 효과. 대식세포는 lipopolysaccharide (LPS)에 노출되면 reactive oxygen species(ROS)나 nitric oxide(NO)와 같은 염증 관련 물질 생성하고 이를 통하여 면역반응을 일으킨다.22 LPS를 처리한 RAW264.7에 PC 젤과 GAC 젤의 용출물을 처리한 후 NO의 생성량을 측정하였다. Figure 3에서 볼 수 있듯이 LPS만을 처리하고 24시간 후에 NO의 생성량은 400 μg/mL 이상이었다. 반면에 PC 젤 100, 250, 500 μg/mL의 용출물을 처리하고 LPS를 처리한 세포에서 NO의 생성량은 각각 240.1±18.4, 206.9±14.5, 210.4±26.9 μg/mL이었다. 동일 농도의 GAC 젤 용출물을 처리하고 LPS를 처리한 세포에서 NO의 생성량은 각각 207.3±8.0, 115.7±8.0, 77.9±2.6 μg/mL이었다. PC 젤과 GAC 젤의 용출물은 모두 NO의 생성을 농도 의존적으로 저해하는 효과를 보였다. 특히, GAC 젤의 용출물은 보다 효과적인 NO 생성 저해 효과를 보였다. Gallic acid는 천연 페놀계 항산화제이며 식품, 의약품 및 화장품에 널리 사용되고 있다.23 폴리페놀은 일반적으로 다양한 생물학적 활성을 가지고 있다고 알려져 있으며, 특히 최근에는 항산화제로 주목을 받고 있다.24
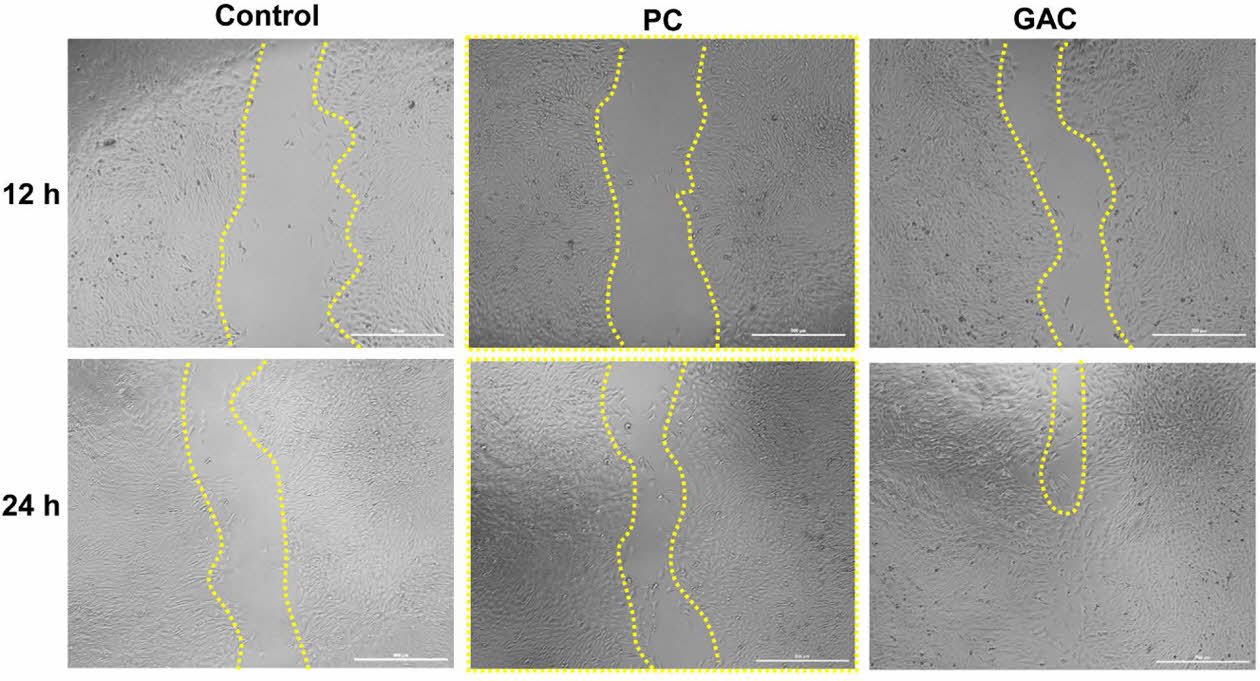
세포 이동성 평가. 세포의 이동은 발생 단계의 조직 형성부터 상처의 치료나 조직 복구에 필수적이다. GAC 젤의 용출물이 세포의 이동에 미치는 영향을 살펴보기 위해 NIH 3T3 섬유아세포를 단층배양하고 scratch를 가해 빈 공간을 만들고 젤의 용출물을 처리하여 세포의 이동성을 평가하였다. Figure 4에서 볼 수 있듯이, 아무것도 처리하지 않은 control 세포의 scratch 간격에 비해 PC 젤의 용출물을 처리한 세포의 scratch 간격이 좁아진 것을 볼 수 있다. 특히, GAC 젤의 용출물을 처리한 세포의 scratch 간격이 가장 좁아졌고, 24시간 후에는 대부분의 scratch 간격이 사라지는 것을 알 수 있었다. 키토산은 창상 치유 과정 중에 세포의 이동과 치유과정을 촉진시킨다고 알려져 있다.25 이 외에도 골조직 형성 증진에 효과가 있다고 알려져 있다.26 Gallic acid는 탄닌산을 가수분해해서 얻을 수 있고 독성이 적으며 우수한 항산화 효과를 보인다.27 따라서, 키토산과 gallic acid의 특성을 고려해 볼 때 GAC는 세포의 이동을 증진시키는 효과를 나타낸다고 생각된다.
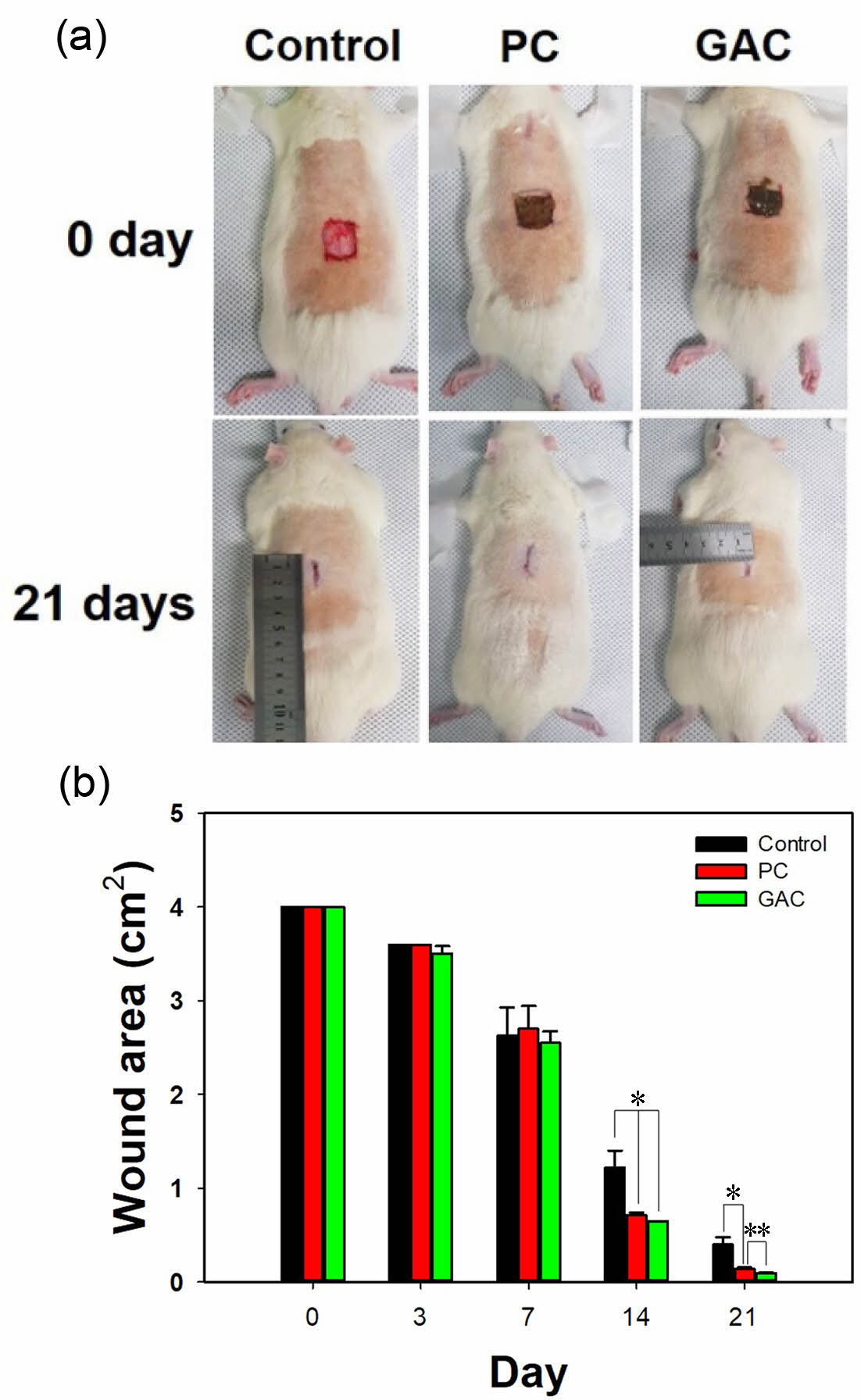
창상치유효과 평가. Rat의 창상 부위에 PC 젤과 GAC 젤을 도포한 후 21일 동안 회복되는 정도를 모니터링했다. Figure 5(a)는 rat의 등 부위에 창상을 만든 후 젤을 도포한 사진이다. 21일 후 사진에서 볼 수 있듯이 GAC 젤을 도포한 rat의 창상 부위의 크기가 가장 작았다. 디지털 카메라로 촬영한 후 ImageJ 프로그램을 이용하여 창상 부위의 회복을 평가하여 Figure 5(b)에 나타냈다. 창상 부위를 만든 후 7일까지 모든 그룹에서 창상 부위의 회복 정도는 유의한 차이를 보이지 않았다. 반면에, 14일 후에는 거즈만을 도포한 control 그룹에 비해 PC 젤 또는 GAC 젤을 도포한 그룹에서의 창상 부위가 유의한 차이로 회복되는 것을 알 수 있었다(*p<0.01). 21일 후에는 GAC 젤을 도포한 rat의 창상 부위의 크기가 유의하게 가장 작았으며 PC 젤을 도포한 그룹의 창상 부위는 거즈만을 도포한 control 그룹에 비해 창상 부위의 크기가 작아졌다. GAC 젤을 도포한 창상 부위가 다른 그룹에 비해 빠르게 회복되는 것을 알 수 있었다.
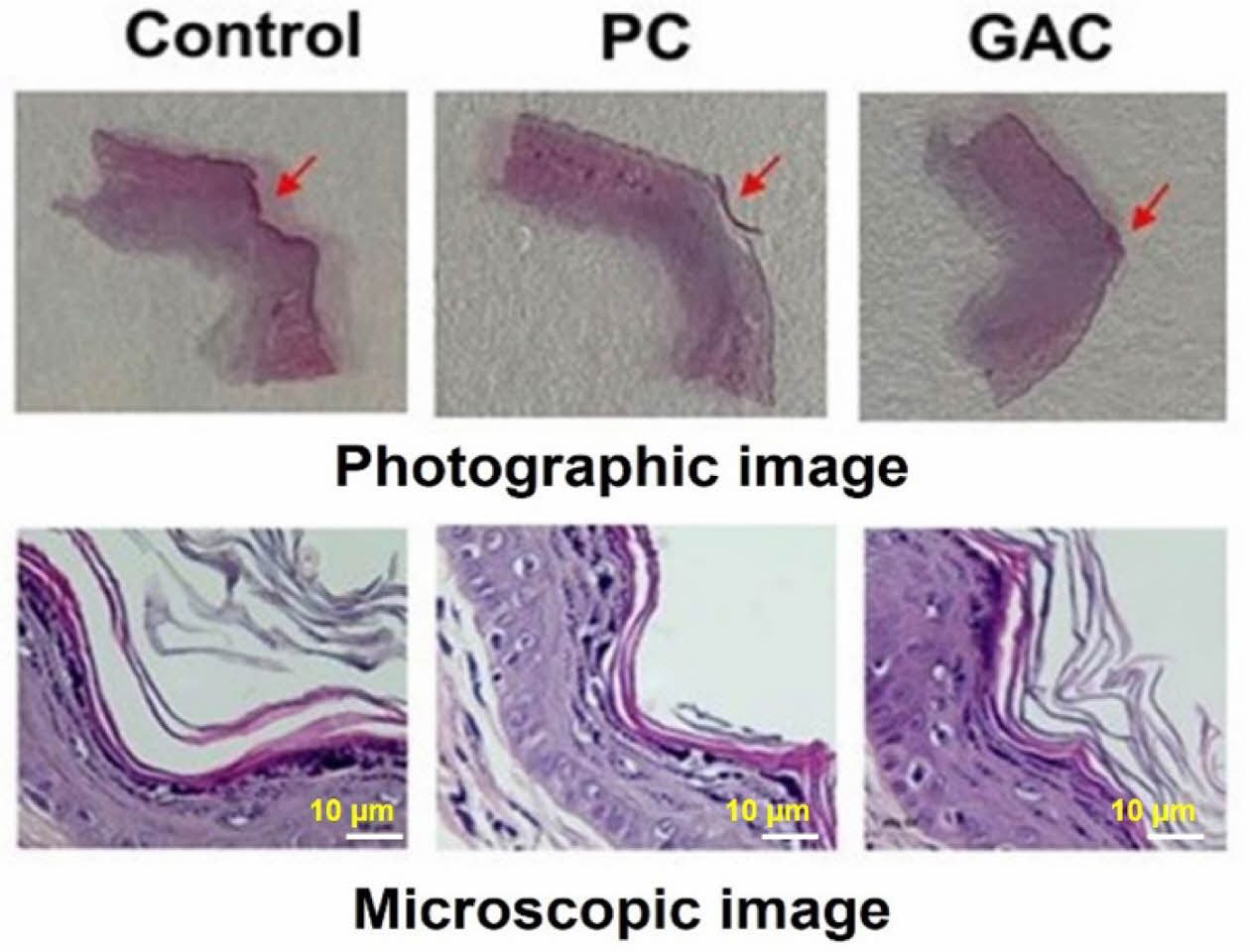
창상 부위의 조직을 떼어내고 H&E 염색한 후 관찰한 결과를 Figure 6에 나타냈다. Figure에서 볼 수 있듯이 창상을 만든 후 21일에 거즈만을 도포한 control 그룹의 창상 부위가 가장 넓게 관찰되고 섬유아세포를 포함한 육아조직과 콜라겐의 피부조직 형성이 가장 늦어지는 것을 알 수 있었다. 반면에 GAC 젤을 도포한 rat의 정상 표피층이 전체 창상면에 형성되고 있는 것을 볼 수 있고 가장 우수한 창상 치유 거동을 보였다. 창상이 발생하게 되면 염증반응 후 혈관과 섬유아세포가 육아조직을 형성하여 상처부위를 채우고 이후 육아조직 내에 결합조직이 채워지며 마지막으로 콜라겐으로 이루어진 결합조직이 재생된다.28
Gallic acid는 항산화 및 항염증 소재로 활용되고 있으며 창상치유 과정 중 조직손상을 막고 염증반응이 초기에 줄어들면서 전체적인 치료 효과를 상승시킨다.29 Gallic acid를 하이드로젤 내에 물리적으로 함유한 경우 gallic acid를 외부 환경으로부터 보호하고 효과를 연장시킬 수 있는 반면, gallic acid를 키토산과 같은 고분자에 공유결합하여 제조한 하이드로젤의 경우 gallic acid가 하이드로 젤에서 방출되지 않고 장기간 존재할 수 있고 하이드로젤의 수분은 상처 개선에 도움을 준다.30,31
결과적으로, GAC 젤은 창상 부위에 습윤환경을 제공하고 육아조직의 형성을 증진하고 창상 치유 속도를 가속화하여 창상 치유에 도움을 주는 것으로 생각된다.
|
Figure 2 Cell viability of RAW264.7 cells treated with the extracts of PC gel or GAC gel at various concentrations. |
|
Figure 3 Inhibition effects of PC gel or GAC gel on LPS-induced NO production in RAW264.7 cells. *p<0.01, **p<0.05 |
|
Figure 4 Photographs of NIH 3T3 cells for migration on scratch site under treatments of the extracts of PC gel or GAC gel. |
|
Figure 5 (a) Photographs; (b) wound area of wound site in rats treated with control (sterile gauze), PC gel, and GAC gel. *p<0.01, **p<0.05 |
|
Figure 6 Histopathological photographs of wound tissue stained with H&E method of control, PC gel, and GAC gel at 21 days after wound preparation (magnification, 400×). |
본 연구에서는 키토산에 gallic acid를 화학적으로 공유 결합하고 젤(gel) 형태로 제조하여 키토산 젤에 비해 창상치유를 보다 효과적으로 유도할 수 있는지 연구하였다. GAC 젤은 PC 젤과 유사하게 세포독성을 보이지 않았으며, RAW264.7 세포에서 LPS로 유도된 NO의 생성을 PC 젤에 비해 효과적으로 저해하였다. 또한, GAC 젤은 섬유아세포의 이동성을 현저하게 증진시켰다. In vivo rat의 창상모델에서 GAC 젤은 PC 젤에 비해 보다 우수한 창상 치유 효과를 보였으며 조직염색에서 창상 부위의 회복을 확인하였다. 따라서, 본 연구에서 제시한 GAC 젤은 창상 부위에서 습윤환경을 제공하고 항산화 작용을 통해 치유를 가속화하는데 도움을 줄 수 있으며, 섬유아세포의 이동성을 증진시킴으로써 창상 부위의 회복에 유용할 것으로 판단된다.
- 1. Shin, H. H.; Bhang S. H. Tissue Engineering Technology for Wound Healing. KCI News 2015, 18, 13-20.
- 2. Lei, V.; Petty, A. J.; Atwater, A. R.; Wolfe, S. A.; MacLeod, A. S. Skin Viral Infections: Host Antiviral Innate Immunity and Viral Immune Evasion. Front. Immunol. 2020, 11, 593901.
-

- 3. Dhivya, S.; Padama, V. V.; Santhini, E. Wound Dressings - a Review. Biomedicine 2015, 5, 24-28.
-

- 4. Kibungu, C.; Kondiah, P. P. D.; Kumar, P.; Choonara, Y. E. This Review Recent Advances in Chitosan and Alginate-based Hydrogels for Wound Healing Application. Front. Mater. 2021, 8, 681960.
-

- 5. Negut, I.; Dorcioman, G.; Grumezescu, V. Scaffolds for Wound Healing Applications. Polymers 2020, 12, 2010.
-

- 6. Devi V. K., A.; Shyam, R.; Palaniappan, A.; Jaiswal, A. K.; Oh, T. H.; Nathanael, A. J. Self-healing Hydrogels: Preparation, Mechanism and Advancement in Biomedical Applications. Polymers 2021, 13, 3782.
-

- 7. Shahin, H.; Aldo R. B. Antibacterial Biohybrid Nanofibers for Wound Dressings. Acta Biomater. 2020, 107, 25-49.
-

- 8. Poshina, D.; Otsuka, I. Electrospun Polysaccharidic Textiles for Biomedical Applications. Textiles 2021, 1, 152-169.
-

- 9. Kim, J.; Lee, K. Y. Evaluation of Korean Pine Byproduct Loaded Poly(vinyl alcohol)/pectin Hydrogel for Wound Healing. Polym. Korea 2015, 39, 543-549.
-

- 10. Hu, Q.; Luo, Y. Polyphenol-chitosan Conjugates: Synthesis, Characterization, and Applications. Carbohydr. Polym. 2016, 151, 624-639.
-

- 11. Khan, F.; Bamunuarachchi, N. I.; Tabassum, N.; Kim, Y. M. Caffeic Acid and Its Derivatives: Antimicrobial Drugs Toward Microbial Pathogen. J. Agric. Food Chem. 2021, 69, 2979-3004.
-

- 12. Qin, Y.; Li, P. Antimicrobial Chitosan Conjugates: Current Synthetic Strategies and Potential Applications. Int. J. Mol. Sci. 2020, 21, 499.
-

- 13. da Rosa, C. G.; Borges, C. D.; Zambiazi, R. C.; Rutz, J. K.; da Luz, S. R.; Krumreich, F. D.; Benvenutti, E. V.; Nunes, M. R. Encapsulation of the Phenolic Compounds of the Blackberry (Rubus fruticosus). LWT-Food Sci. Technol. 2014, 58, 527-533.
-

- 14. Comino-Sanz, I. M.; López-Franco, M. D.; Castro, B.: Pancorbo-Hidalgo, P. L. The Role of Antioxidants on Wound Healing: A Review of the Current Evidence. J. Clin. Med. 2021, 10, 3558.
-

- 15. Kaczmarek, B.; Mazur, O.; Miłek, O.; Michalska-Sionkowska, M.; Osyczka, A. M.; Kleszczyʼnski, K. Development of Tannic Acid-enriched Materials Modified by Poly(ethylene glycol) for Potential Applications as Wound Dressing. Prog. Biomater. 2020, 9, 115-123.
-

- 16. Cho, Y. S.; Kim S. K.; Ahn, C. B.; Je, J. Y. Preparation, Characterization, and Antioxidant Properties of Gallic Acid-grafted-chitosans. Carbohydr. Polym. 2011, 83, 1617-1622.
-

- 17. Kim, J.; Kim, M. J.; Lee, K. Y. Wound Healing Effect of Curcumin Gel for Transdermal Delivery. Polym. Korea 2013, 37, 387-392.
-

- 18. Oh, Y.; Ahn, C. B.; Marasinghe, M. P. C. K.; Je, J. Y. Insertion of Gallic Acid onto Chitosan Promotes the Differentiation of Osteoblasts from Murine Bone Marrow-derived Mesenchymal Stem Cells. Int. J. Biol. Macromol. 2021, 183, 1410-1418.
-

- 19. Bai, J.; Zhang, Y.; Tang C.; Hou, Y.; Ai, X.; Chen, X.; Zhang, Y.; Wang, X.; Meng, X. Gallic Acid: Pharmacological Activities and Molecular Mechanisms Involved in Inflammation-related Diseases. Biomed. Pharmacother. 2021, 133, 110985.
-

- 20. Madera-Santana, T. J.; Herrera-Méndez, C. H.; Rodriguez-Núñez, J. R. An Overview of the Chemical Modifications of Chitosan and Their Advantages. Green Mater. 2018, 6, 131-142.
-

- 21. Kaparekar, P. S.; Pathmanapan, S.; Anandasadagopan, S. K. Polymeric Scaffold of Gallic Acid Loaded Chitosan Nanoparticles Infused with Collagen-fibrin for Wound Dressing Application. Int. J. Biol. Macromol. 2020, 165, 930-947.
-

- 22. Mittal, M.; Siddiqui, M. R.; Tran, K.; Reddy, S. P.; Malik, A. B. Reactive Oxygen Species in Inflammation and Tissue Injury. Antioxid. Redox Signal 2014, 20, 1126-1167.
-

- 23. Lu, Z.; Nie, G.; Belton, P. S.: Tang, H.; Zhao, B. Structure-activity Relationship Analysis of Antioxidant Ability and Neuroprotective Effect of Gallic Acid Derivatives. Neurochem. Int. 2006, 48, 263-274.
-

- 24. Tuchmantel, W.; Kozikowski, A. P.; Romanczyk Jr., L. J. Studies in Polyphenol Chemistry and Bioactivity. 1. Preparation of Building Blocks from (+)-catechin. Procyanidin Formation. Synthesis of the Cancer Cell Growth Inhibitor, 3-O-galloyl-(2R,3R)-epicatechin-4β,8-[3-O-galloyl-(2R,3R)-epicatechin]. JACS 1999, 121, 12073-12081.
-

- 25. Feng, P.; Luo, Y.; Ke, C.; Qiu, H.; Wang, W.; Zhu, Y.; Hou, R.; Xu, L.; Wu, S. Chitosan-based Functional Materials for Skin Wound Repair: Mechanisms and Applications. Front. Bioeng. Biotechnol. 2021, 9, 650598.
-

- 26. Levengood, S. L.; Zhang, M. Chitosan-based Scaffolds for Bone Tissue Engineering. J. Mater. Chem. B Mater. Biol. Med. 2014, 2, 3161-3184.
-

- 27. Bajpai, B.; Patil, S. A New Approach to Microbial Production of Gallic Acid. Braz. J. Microbiol. 2008, 39, 708-711.
-

- 28. Reinke, J. M.; Sorg, H. Wound Repair and Regeneration. Eur. Surg. Res. 2012, 49, 35-43.
-

- 29. Barros, A. S. A.; Carvalho, H. O.; Ferreira dos Santos, I. V.; Taglialegna, T.; Ingret dos Santos Sampaio, T.; Duarte, J. L.; Fernandes, C. P.; Carvalho, J. C. T. Study of the Non-clinical Healing Activities of the Extract and Gel of Portulaca pilosa L. in Skin Wounds in Wistar Rats: A Preliminary Study. Biomed. Pharmacother. 2017, 96, 182-190.
-

- 30. Vitonyte, J.; Manca, M. L.; Caddeo, C.; Valenti, D.; Peris, J. E.; Usach, I.; Nacher, A.; Matos, M.; Gutiérrez, G.; Orrù, G.; Fernàndez-Busquets X.; Fadda, A. M.; Manconi, M. Bifunctional Viscous Nanovesicles Co-loaded with Resveratrol and Gallic Acid for Skin Protection Against Microbial and Oxidative Injuries. Eur. J. Pharm. Biopharm. 2017, 114, 278-287.
-

- 31. Hong, S. S.; Kim, J. H.; Li, H.; Shim, C. K. Advanced Formulation and Pharmacological Activity of Hydrogel of the Titrated Extract of C. asiatica. Arch. Pharm. Res. 2005, 28, 502-508.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2022 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2023; 47(1): 58-63
Published online Jan 25, 2023
- 10.7317/pk.2023.47.1.58
- Received on Sep 21, 2022
- Revised on Oct 26, 2022
- Accepted on Oct 27, 2022
 Services
Services
Shared
 Correspondence to
Correspondence to
- Jae-Young Je*** , and Chang-Moon Lee****, *****, ******
-
***Division of Smart Healthcare, Pukyong National University, Busan 48513, Korea
****School of Healthcare and Biomedical Engineering, Chonnam National University, Yeosu 59626, Korea
*****Department of Biomedical Engineering, Chonnam National University, Yeosu 59626, Korea
******Research Center of Healthcare and Biomedical Engineering, Chonnam National University, Yeosu 59626, Korea - E-mail: jjy1915@pknu.ac.kr, cmlee@jnu.ac.kr
- ORCID:
0000-0002-4800-0566, 0000-0002-9119-6154









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.