- One-step Preparation of Microbiogels for Cosmetic by W/O Fomulations
Won-Wook Jeong*, **, Sang Gwon Seo*, Eui Jung Lee*, Joo-young Oh*, Baohai Pan**, Hyung-il Kim**, and Kyung Jin Lee**,†

*Clean Beauty R&D Center, LG Science Park E12, LG H&H Ltd., Seoul 07795, Korea
**Department of Chemical Engineering and Applied Chemistry, Chungnam National University, Daejeon 34134, Korea- W/O 제형에 의한 화장품용 마이크로바이오젤의 One-step 제조
*엘지생활건강 기술연구원 클린뷰티 연구소, **충남대학교 응용화학공학과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Microbiogels are biocompatible and biodegradable, so they have various biomedical applications such as drug delivery and their manufacturing methods. However, it has drawbacks such as unstable yield, multi-step procedure, and cumbersome separation process. This study presented a simple one-step method for preparing microbiogel directly during water-in-oil (W/O) emulsion manufacturing process of cosmetics. We controlled the critical gelation temperature (Tgel) of biogel by carrageenan and polyol content and the particle size of microbiogels in emulsions by food emulsifier content. We moniter the release of encapsulated gelatin in microbiogel over Tgel and find the release of the encapsulants can be regulated by controlling the temperature. We find this microbiogel increases the complex modulus (G*) of emulsion. This one-step method is of great value in the study of W/O cosmetic formulations that can encapsulate various active ingredients in microbiogels.
마이크로바이오젤은 생체적합 및 생분해성으로 약물전달 같은 생의학적 응용과 그 제조 방법이 다양하나 불안정한 수율, 다단계 절차, 번거로운 분리과정들이 수반되는 약점이 있다. 본 연구는 화장품의 water-in-oil(W/O) 에멀젼 제조 과정 중에 직접 마이크로바이오젤을 제조하는 간단한 one-step 방법을 제시한다. 우리는 천연 카라기난으로 제조한 바이오젤의 임계 젤화 온도(Tgel)를 카라기난과 폴리올의 함량으로 조절하고, W/O 에멀젼 내 마이크로바이오젤의 입자 크기를 식품 유화제 함량으로 조절하였다. 또한 이 마이크로바이오젤에 캡슐화시킨 젤라틴의 방출을 Tgel이상에서 모니터링함으로써, 온도 제어로 캡슐화 물질의 방출을 조절할 수 있음을 확인하였고, 이 마이크로바이오젤이 에멀젼의 복소 탄성계수(G*)를 증가시킨다는 것도 알게 되었다. 이 one-step 방법은 다양한 유효성분을 마이크로바이오젤 내 캡슐화할 수 있는 W/O 화장품 제형 연구에 중요한 가치가 있다.
A simple one-step method was developed for preparing microbiogel directly during water-in-oil (W/O) emulsion manufacturing process of cosmetics. Monitoring the release of encapsulated gelatin in microbiogel above Tgel has shown that drug release can be controlled by the temperature.
Keywords: microbiogels, carrageenan, W/O emulsion, cosmetic formulations, encapsulate.
이 연구는 LG생활건강의 연구비를 지원받아 수행하였습니다.
저자들은 이해상충이 없음을 선언합니다.
마이크로젤은 크기가 1~100 마이크로미터 범위인 구형 고분자 젤 입자를 말한다. 이들은 약물전달, 세포전달/이식, 이미징 보조 같은 다양한 생의학 응용 분야에 매력적이다.1-4 대부분의 마이크로젤은 폴리아크릴아미드 및 폴리(n-이소프로필아크릴아미드)와 같은 합성 고분자로 만들어진다.5-7 따라서 미반응 단량체 및 개시제에 대한 잠재적인 생물 안전 문제로 인해 생물 의학 공용 분야에 제한이 있다. 따라서, 이러한 한계를 극복하기 위하여 생물 친화적 재료, 바이오 유래 물질 등을 이용한 마이크로젤의 제조에 대한 연구가 지속되고 있다. 최근 생체 적합성과 무독성의 이상적인 소재로써 바이오젤(biogel)이 거론되고 있다. 이는 젤라틴, 알지네이트, 전분, 카라기난를 포함한 다양한 바이오폴리머의 3차원 네트워크를 통해 구현된 물질이며,8-13 이러한 바이오젤의 입자를 제조하는 방법은 분무 건조, 코아세르베이트, 미세유체 장치 사용, 또는 water-in-oil(W/O) 에멀젼 기술들이 있다. 하지만, 불안정한 수율, 다단계 절차 및 원심분리, 세척 등 반복되는 번거로운 분리과정들이 수반되는 약점이 있다.14-18 본 연구에서는 최종 마이크로바이오젤 입자를 안정적으로 화장품의 W/O 에멀젼 처방과 제조 기술로 만들어냄으로써, “마이크로바이오젤-인-오일 에멀젼(microbiogel-in-oil emulsion)” 화장품 그 자체를 바로 피부에 안전하게 사용할 수 있는 새로운 제조 방법을 제시하고자 한다.
본 연구에서 마이크로바이오젤 소재로는 카파-카라기난(kappa-carrageenan)을 사용하였고, 적용한 화장품 제형은 기존에 제한적인 결과만이 보고된 W/O 에멀젼 제조 기술을 도입하였다. 특히 W/O 에멀젼 처방은 PEG-free, silicone free로 제조하여 피부에 보다 안전한 처방으로 조성하였다. 계면활성제로는 마가린, 버터, 샐러드 드레싱 및 초콜릿과 같은 W/O 에멀젼을 안정화하는데 널리 사용되는 소수성 유화제인 폴리글리세릴폴리리시놀리에이트를 사용하고,19 유상 오일로는 피부구성 유사성분인 트리글리세라이드 및 식물성 스쿠알란을 사용하였다. 본 연구는 카라기난 농도, 폴리올의 농도에 따른 마이크로바이오젤의 임계 젤화 온도(Tgel) 변화와 계면활성제 농도에 따른 W/O 에멀젼 내 마이크로바이오젤의 입자 크기 조절 및 마이크로바이오젤에 캡슐화시킨 유효성분의 방출 제어를 모니터링하고, 마이크로바이오젤이 W/O 에멀젼의 점탄성 거동에 미치는 영향을 연구하였다.
원료.실험에 사용된 수상 원료인 카파-카라기난은 CP Kelco(Atlanta, GA)의 식품 grade 원료를 구입하여 사용하였고, MgSO4는 K+S Minerals and Agriculture GmbH(Kassel, Germany)에서 구입하였다. 폴리올 글리세린(glycerin)은 LG H&H CO., Ltd.(Korea), 1,2-헥산디올은 ActivON CO., Ltd. (Korea), 유상 원료인 계면활성제 폴리글리세릴-6폴리리시놀리에이트는 Nippon Surfactant Industries(Tokyo, Japan)에서 공급받았다. 오일인 카프릴릭/카프릭트리글리세라이드(caprylic/capric triglyceride), 식물성 스쿠알란(squalan)은 각각 Palm-Oleo(Klang) Sdn. Bhd.(Selangor, Malaysia), CAROI'LINE COSMETICA S.L.(Pontevedra, Spain)로부터 공급받았다. 카라기난 바이오젤의 형광 방출 관찰을 위한 모델 캡슐화제(model encapsulant)로는 Invitrogen(Waltham, MA)의 Gelatin From Pig Skin, Oregon GreenTM 488 conjugate(G13186)을 사용하였다.
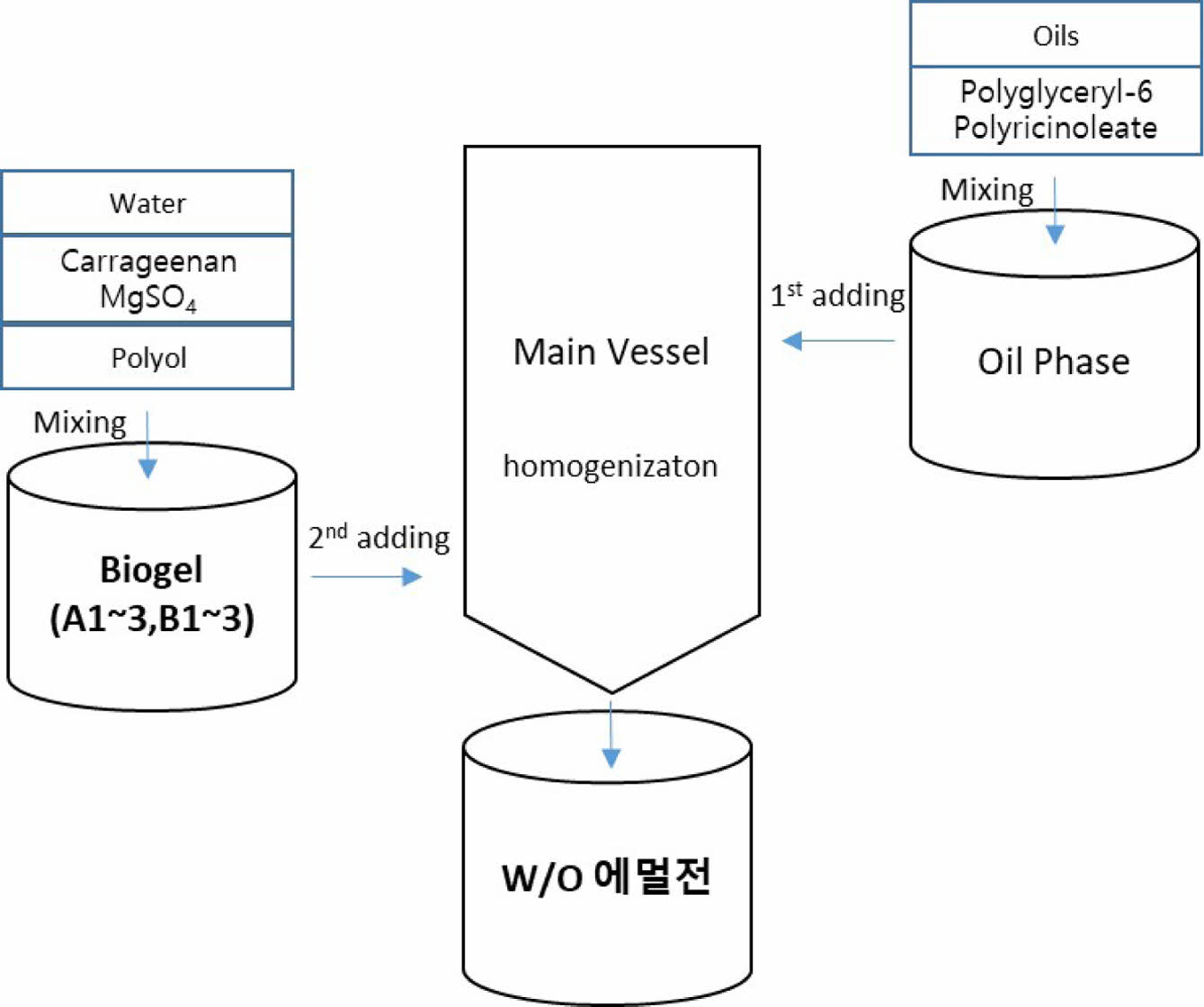
바이오젤 및 W/O 에멀젼 제조.바이오젤 제조 및 W/O에멀젼 화장품 제조 모식도를 Figure 1에 나타냈다. 비이커에 정제수를 넣고 온도를 55 ℃로 유지시킨 상태에서, 카라기난을 disper로 2000 rpm, 5분간 분산시킨 후, 폴리올을 넣고 동일하게 분산 시키고, 마지막으로 MgSO4를 넣고 다시 동일하게 분산시켜서 최종 카라기난 바이오젤(sample A1~3, B1~3)을 준비한다(여기서 바이오젤 자체를 샘플로 실험하기 위해선 추가로 28 ℃ 까지 냉각, 탈포한다). 또 다른 비이커에 계면활성제와 oil 성분들을 포함한 유상 원료들을 넣고 온도를 55 ℃로 유지시켜, disper로 2000 rpm, 10 분간 분산시켜 유상(oil phase)를 준비한다. 그 다음 별도의 메인 비이커(main vessel)에 준비한 유상을 먼저 투입하고, 온도를 55 ℃로 유지시켜 homo-mixer로 2000 rpm, 5분간 교반시킨 후, 준비한 카라기난 바이오젤을 서서히 투입하면서 homo-mixer로 2000 rpm, 5분간 교반시키고, 바이오젤이 모두 투입된 후 다시 homo-mixer로 4000 rpm, 5분간 교반시키고 나서, 28 ℃까지 냉각, 탈포하여 최종 W/O 에멀젼(biogel-in-oil emulsion)을 얻는다.
레올로지 측정.제조된 카라기난 바이오젤의 점탄성측정은 균일한 온도를 보장하고 카라기난 용액에서 수분 증발을 방지하기 위해 용매 트랩이 있는 petier plate를 이용하여 스트레스-제어 레오미터(stress-controlled rheometer, HAAKE MARS II, Thermo Fisher Scientific)로 얻었다. 저장 탄성률(storage moduli, G') 및 손실 탄성률(loss moduli, G")은 Tgel(G'과 G"이 교차하는 온도, gelation temperature or gel point)을 결정하기 위해, 온도를 변화시키면서 1H의 진동 주파수(oscillatory frequency)에서 평행판 형상(parallel-plate geometry, 지름 40 mm)으로 0.1 Pa의 전단 응력을 적용하여 측정하였다. 온도는 각 온도 단계마다 2분의 평형 시간으로 2분씩 20 ℃에서 40 ℃까지 변화시켰다. 그리고, 제조된 W/O 에멀젼의 점탄성은 복소 탄성계수(dynamic viscoelasticity, G*)를 측정하여 에멀젼의 강성(stiffness)를 정량적으로 측정하였다.
현미경 관찰.제조된 W/O 에멀젼의 현미경 관찰은 Leica Application Suite X 기기(20× 대물 렌즈)를 사용하였고, 형광 관찰은 Leica 형광 현미경을 사용하였다.
|
Figure 1 Preparation of biogel and W/O emulsion (biogel-in-oil). |
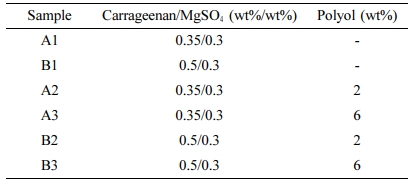
제조된 카라기난 바이오젤의 샘플명, 조성을 Table 1에 요약하여 나타냈다. A1~3는 카라기난 함량은 0.35 wt%, MgSO4는 0.3 wt%로 고정하고, 폴리올 함량을 각각 0 wt%, 1,2-헥산디올 2 wt%, 1,2-헥산디올/글리세린 2 wt%/4 wt%를 추가하였고, B1~3은 카라기난 함량을 0.5 wt%, MgSO4는 0.3 wt%로 고정하고, 폴리올을 A와 동일하게 각각 추가하였다.
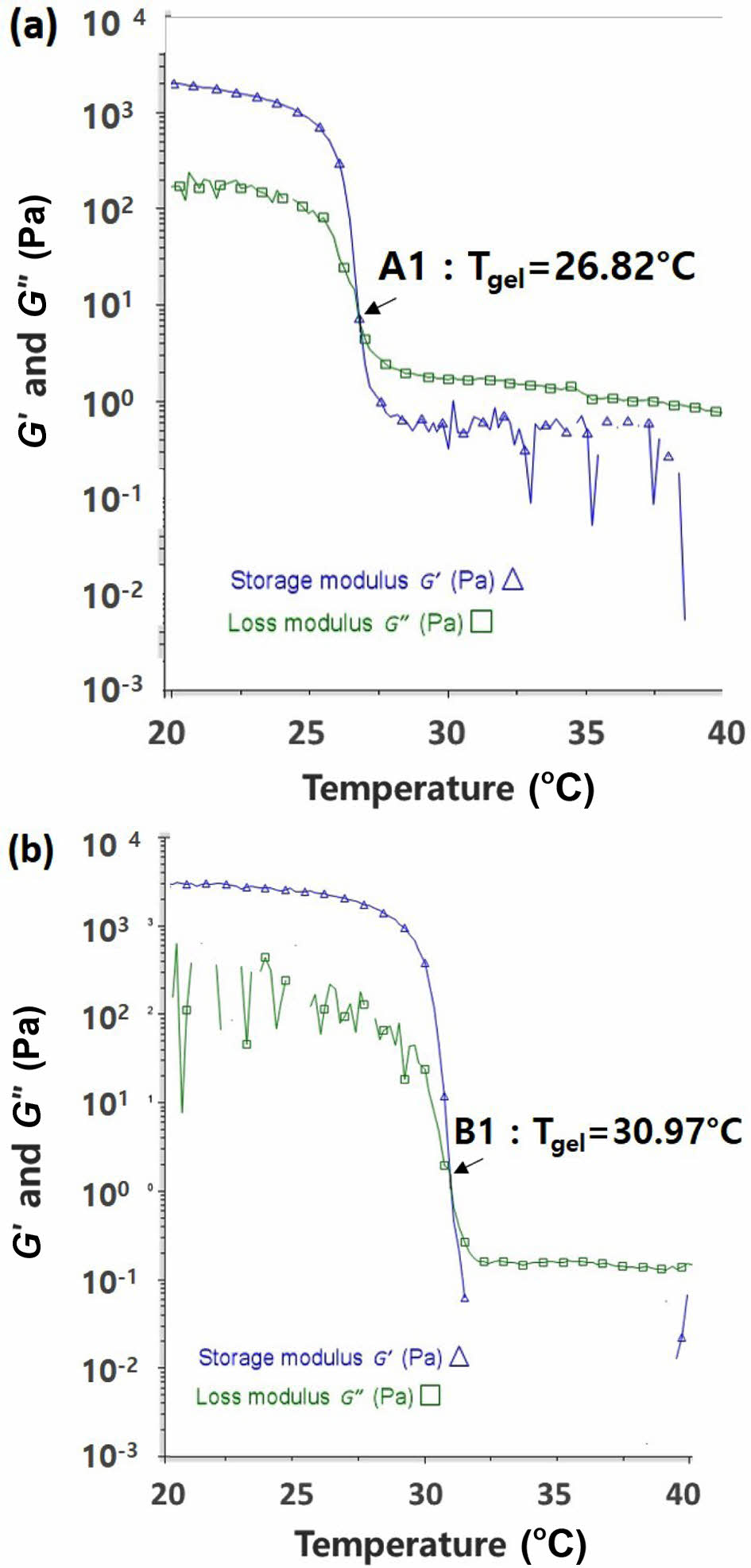
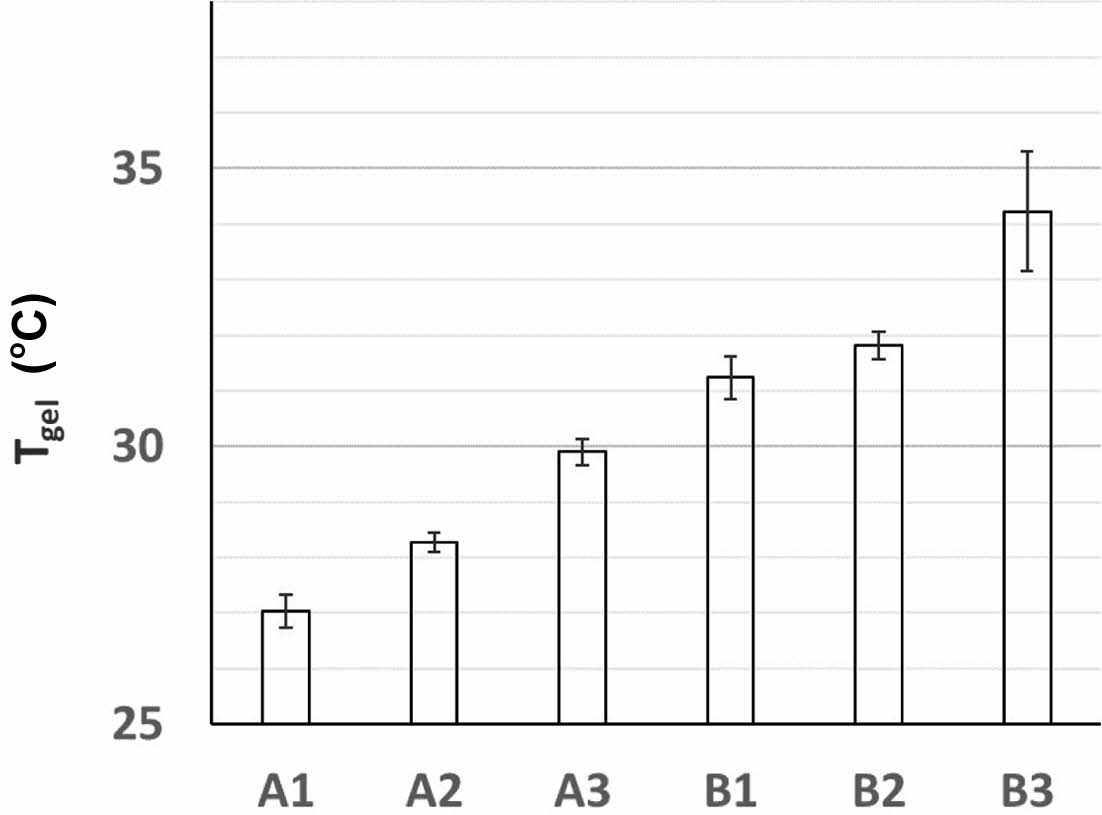
바이오젤의 레올로지 A1~3, B1~3의 점탄성 결과를 Figure 2와 Figure 3에 나타내었다. 바이오젤의 점탄성 성질은 G'과 G"으로 표현될 수 있으며, 이 점탄성 결과로부터 G' 가 G"와 같아지는 온도, Tgel 역시 확인하였다. 각 샘플의 Tgel은 W/O 에멀젼 내 마이크로바이오젤에 캡슐화된 형광 젤라틴의 온도에 따른 방출 실험에도 중요한 의미가 있다. Figure 2(a) A1 (카라기난 0.35 wt%)과 Figure 2(b) B1(카라기난 0.5 wt%)을 보면, 카라기난 농도가 증가함에 따라, 점탄성 그래프가 우측으로 이동하는 것을 확인할 수 있다. 이는 카라기난 농도 증가로 바이오젤의 3차원 구조(gelation)가 강화된 것으로 해석 될 수 있다.20 그리고 A1과 B1의 Tgel 또한, 각각 26.82 ℃, 30.97 ℃로 증가함을 확인하였다. 바이오젤의 점탄성 거동과 Tgel의 변화를 카라기난 함량별(A1, B1) 이외에도, 화장품에서 흔히 사용되는 폴리올(보습성분)을 추가하여 확인해보았다. Figure 2와 동일한 레오미터 측정 방식으로 A1~3, B1~3의 Tgel 평균값을 Figure 3에 막대그래프로 나타내었다. A1~3의 Tgel은 각각 27.04, 28.28, 29.90 ℃, B1~3은 각각 31.24, 31.82, 34.23 ℃를 얻었다. 각 카라기난 농도에서 폴리올 함량을 증가시켰을 때, 모두 Tgel이 증가하는 것을 볼 수 있다. 이는 폴리올의 OH기가 카라기난과 수소결합 등 상호작용으로 바이오젤이 강화됨을 뜻한다.21,22 이 결과들로부터, 카라기난 함량과 폴리올 함량 조절로 바이오젤의 Tgel을 컨트롤할 수 있음을 확인할 수 있었다.
마이크로바이오젤 입자 크기 조절 A1(biogel)와 유상(oil phase)을 50/50 wt%로 고정하고, 유상 내에서 계면활성제 폴리글리세릴-6폴리리시놀리에이트를 각각 2, 6, 10 wt%로 각각 변화시켜 제조한 W/O 에멀젼을 광학 현미경으로 관찰한 결과를 Figure 4(a)~(c)에 나타내었다. 계면활성제 함량을 증가시킬수록 마이크로바이오젤의 입자들이 전반적으로 작아지고 균일해지는 것을 확인할 수 있었다. 이렇게 에멀젼 상에서의 마이크로바이오젤도 실제 사용 시 외부 자극에 대하여 동일한 동적 거동을 보이므로, 입자 크기와 균일성의 조절 가능성의 확보는, 유효성분 전달 모델링, 탐지 및 예측 관점에서 매우 중요하다고 할 수 있다.23-25
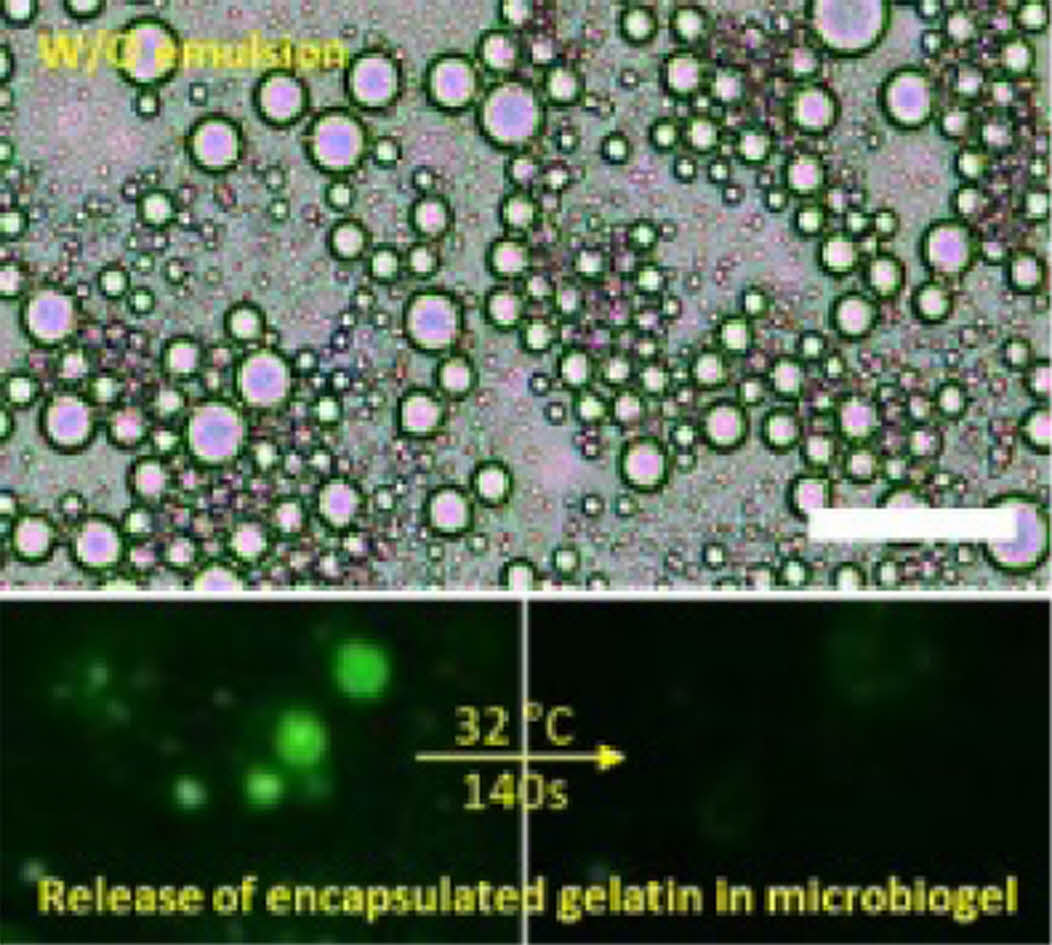
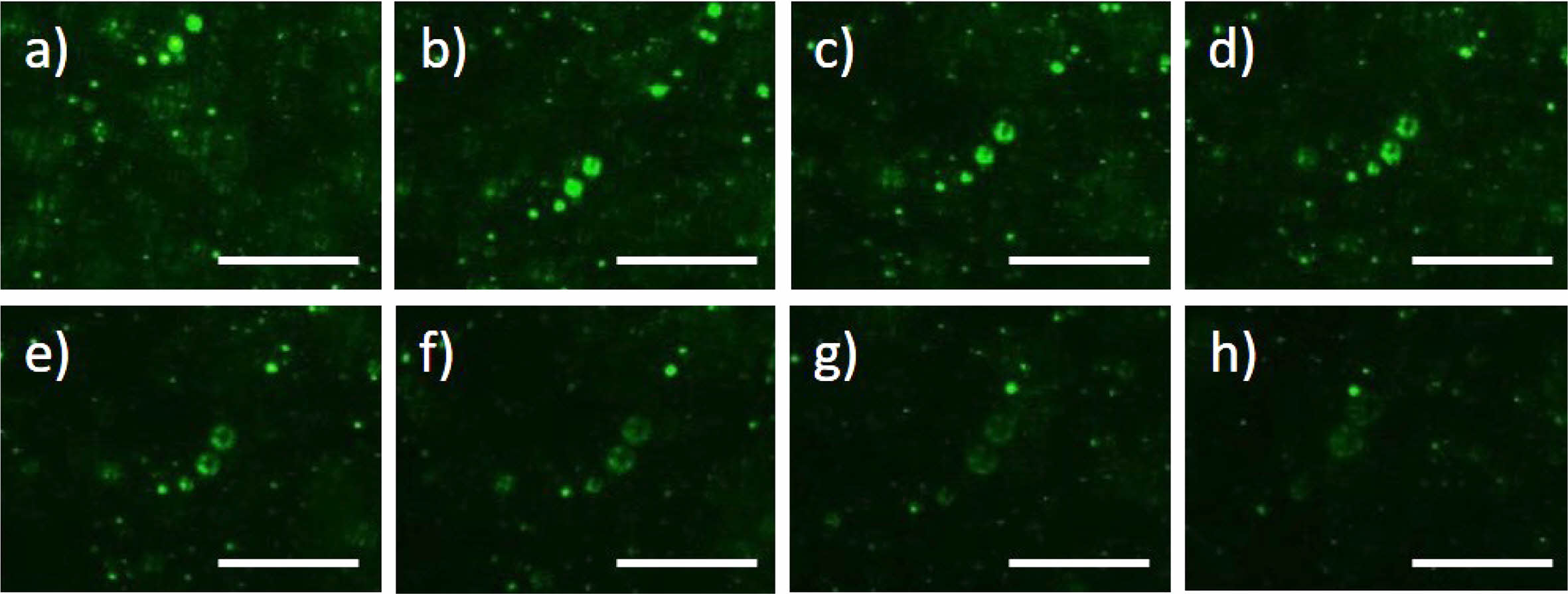
형광 함유 A1 에멀젼의 온도감응 Tgel 보다 높은 온도에서, W/O 에멀젼 내 바이오젤의 거동과 형광의 방출 거동을 관찰한 결과를 Figure 5와 6에 나타내었다. A1(biogel)과 유상(oil phase)을 50/50 wt%로 고정하고, 유상 내에서 계면활성제 폴리글리세릴-6폴리리시놀리에이트를 6 wt%로 고정하여 W/O 에멀젼을 제조하였고, 형광 관찰을 위해 A1에 형광 콜라겐(gelatin from pig skin, Oregon GreenTM 488 conjugate) 0.02 wt%를 따로 첨가하였다. Figure 5를 보면, 34 ℃에서 에멀젼 내의 A1 마이크로바이오젤 입자가 시간에 따라 보이지 않게 되는걸 관찰할 수 있는데, 이는 마이크로바이오젤(A1)이 Tgel 이상에서 3차원 네트워크가 붕괴되면서19 젤이 녹아 주변으로 흩어져서 입자 형태가 사라지는 것으로 해석된다. 이 현상으로 인해, 3차원 네트워크 마이크로바이오젤 안에 캡슐화되어 있던 형광 젤라틴이 온도와 시간에 따라 붕괴되는 젤과 함께 주변으로 흩어져 그 형광 강도가 옅어지는 것이 Figure 6에서도 관찰되었다. 이러한 마이크로바이오젤에 캡슐화된 유효성분의 온도에 따른 거동은, 특히 W/O 에멀젼 화장품의 피부 온도 감응의 약물전달 연구에도 큰 의미를 갖는다.
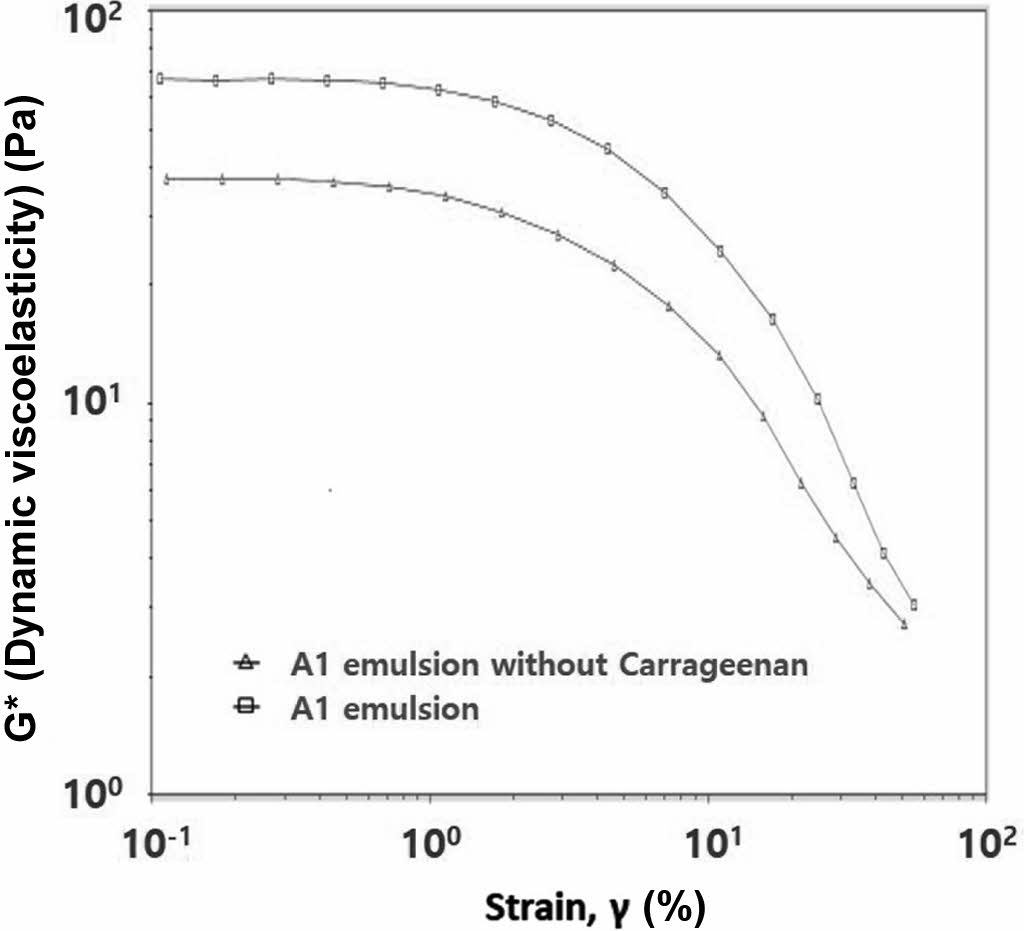
카라기난 유무 A1 에멀젼의 레올로지 마이크로바이오젤의 카라기난 유무에 따른 W/O 에멀젼의 G*를 측정하여 그 결과를 Figure 7에 나타내었다. 카라기난 유무의 A1과 유상(oil phase)을 50/50 wt%로 고정하여 W/O 에멀젼을 만들었을때, 카라기난이 없는 에멀젼보다, 카라기난이 있는 A1(biogel) 에멀젼이 G*가 높았다. 이는 3차원 네트워크 구조를 가진 마이크로바이오젤 입자가 에멀젼의 강성을 증가시키는 것으로 이해되며, 이는 화장품 사용시 젤 텍스쳐를 부여할 수 있을 것으로 기대된다.
|
Figure 2 Temperature dependence of the dynamic moduli and Tgel of (a) A1; (b) B1. |
|
Figure 3 Tgel of A1, A2, A3 and B1, B2, B3 vs. concentration of polyols. Data were expressed as mean ± standard. |

|
Figure 4 Optical microscopy images and particle size of W/O emulsion with A1 microgels vs. concentration of surfactant temperatures: (a) 2 wt%; (b) 6 wt%; (c) 10 wt%. The scale bars are 50 µm. |

|
Figure 5 Optical microscope images of W/O emulsion with A1 microgels containing gelatin from pig skin, Oregon GreenTM 488 conjugate, at 34 ℃ for (a) 0s; (b) 30s; (c) 60s; (d) 90s; (e) 120s; (f) 150s; (g) 180s; (h) 210s; (i) 240s; (j) 270s. All scale bars are 100 μm. |
|
Figure 6 Fluorescence microscope images of W/O emulsion with A1 microgels containing gelatin from pig skin, Oregon GreenTM 488 conjugate, at 32 ℃ for (a) 0s; (b) 20s; (c) 40s; (d) 60s; (e) 80s; (f) 100s; (g) 120s; (h) 140s. All scale bars are 50 μm. |
|
Figure 7 Viscoelastic behavior of W/O emulsion with A1 microgels. |
본 연구에서는 화장품의 W/O 에멀젼 제조 과정 중에 직접 마이크로바이오젤을 제조하는 간단한 one-step 방법을 제시하였다. 제조된 바이오젤은 카라기난과 폴리올의 함량이 증가함에 따라 임계 젤화 온도, Tgel이 증가하였고, W/O 에멀젼 제조 시 계면활성제 함량을 증가시킴으로서 카라기난 마이크로바이오젤의 입자 사이즈를 전반적으로 작고 균일하게 조절 할 수 있었다. W/O 에멀젼 내 마이크로바이오젤에 캡슐화시킨 젤라틴의 방출을 Tgel 이상에서 모니터링함으로써, 온도 제어로 캡슐화 물질의 방출을 조절할 수 있음을 확인하였고, 이 마이크로바이오젤은 W/O 에멀젼의 강성과 연관있는 G*를 증가시킨다는 것을 확인함으로써 향후 화장품의 중요한 감성 품질 연구에도 도움이 된다. 본 연구에서의 W/O 에멀젼 제조 방법을 이용하여 안정적으로 카라기난 마이크로바이오젤을 제조할 수 있음을 제시하고, 다양한 약물을 이러한 다양한 소재의 마이크로바이오젤 안에 캡슐화할 수 있다는 가능성은 W/O 화장품 제형 연구에 중요한 가치가 있다.
- 1. Frykman, S.; Srienc, F. Quantitating Secretion Rates of Individual Cells: Design of Secretion Assays. Biotechnol. Bioeng. 1998, 59, 214-226.
-

- 2. Dove, A. Cell-based Therapies go Live. Nat. Biotechnol. 2002, 20, 339-343.
-

- 3. Borisov, S. M.; Wolfbeis, O. S. Temperature-sensitive Europium (III) Probes and Their Use for Simultaneous Luminescent Sensing of Temperature and Oxygen. Anal. Chem. 2006, 78, 5094-5101.
-

- 4. Han, M.; Yun, J.; Lee, Y.; Kim, H. Preparation and pH-Sensitive Release Behavior of Alginate/Activated Carbon Composite Magnetic Hydrogels. Carbon Lett. 2010, 11, 122-126.
-

- 5. Retama, J. R.; Lopez-Ruiz, B.; Lopez-Cabarco, E. Microstructural Modifications Induced by the Entrapped Glucose Oxidase in Cross-linked Polyacrylamide Microgels Used as Glucose Sensors, Biomaterials. 2003, 24, 2965-2973.
-

- 6. Kratz, K.; Lapp, A.; Eimer, W.; Hellweg, T. Volume Transition and Structure of Triethyleneglycol Dimethacrylate, Ethylenglykol Dimethacrylate, and N,N'-methylene Bis-acrylamide Cross-linked Poly(N-isopropyl acrylamide) Microgels: a Small Angle Neutron and Dynamic Light Scattering Study. Colloid Surf. A 2002, 197, 55-67.
-

- 7. Lee, J.; Park, T.; Lee, K. J.; Lahann, J. Snail-like Particles from Compartmentalized Microfibers. Macromolecular Rapid. Comms. 2016, 37, 73-78.
-

- 8. Tabata, Y.; Ikada, Y. Protein Release from Gelatin Matrices. Adv. Drug Deliver. Rev. 1998, 31, 287-301.
-

- 9. Coppi, G.; Iannuccelli, V.; M. T.; Cameroni, R. Alginate Microparticles for Enzyme Peroral Administration. Int. J. Pharm. 2002, 242, 263-266.
-

- 10. Dafe, A.; Etemadi, H.; Zarredar, H.; Mahdavinia, G. R. Development of Novel Carboxymethyl Cellulose/k-carrageenan Blends as an Enteric Delivery Vehicle for Probiotic Bacteria, Int. J. Biol. Macromol. 2017, 97, 299-307.
-

- 11. Park, Y.; Sung, J. H.; Kim, B. Tailoring Network Structure of Photopolymerizable Gelatin Hydrogels as 3D Cell Culture Scaffolds. Polym. Korea 2022, 46, 793-798.
-

- 12. An, H. G.; Lee, H. M. Antioxidant Properties and Characterization of Contact Lenses Containing Tannic Acid and Seaweed Polysaccharides. Polym. Korea 2022, 46, 775-782.
-

- 13. Ahn, G.; Choi, I.; Yun, T. H.; Choi, S. Fabrication of Starch-Lauric Acid Nanoparticles for Potential Tumor Therapy, Polym. Korea 2021, 45, 62-67.
-

- 14. Bruschi, M. L.; Cardoso, M. L. C; Lucchesi, M. B.; Gremião, M. P. D. Gelatin Microparticles Containing Propolis Obtained by Spray-drying Technique: Preparation and Characterization, Int. J. Pharm. 2003, 264, 45-55.
-

- 15. Chen, S.; Wu, Y.; Mi, F.; Lin, Y.; Yu, L.; Sung, H. A Novel pH-Sensitive Hydrogel Composed of N,O-carboxymethyl Chitosan and Alginate Cross-linked by Genipin for Protein Drug Delivery. J. Control. Release 2004, 96, 285-300.
-

- 16. Zhang, H.; Tumarkin, E.; Peerani, R.; Nie, Z.; Sullan, R. M. A.; Walker, G. C.; Kumacheva, E. Microfluidic Production of Biopolymer Microcapsules with Controlled Morphology, J. Am. Chem. Soc. 2006, 128, 12205-12210.
-

- 17. Ellis, A.; Jacquier, J. C. Manufacture of Food Grade j-carrageenan Microspheres, J. Food Eng. 2009, 94, 316-320.
-

- 18. Skaff, H.; Lin, Y.; Tangirala, R.; Breitenkamp, K.; Boeker, A.; Russell, T. P.; Emrick, T. Crosslinked Capsules of Quantum Dots by Interfacial Assembly and Ligand Crosslinking, Adv. Mater. 2005, 17, 2082-2086.
-

- 19. Okuro, P. K.; Gomes, A.; Costa, A. L. R.; Adame, M. A.; Cunha, R. L. Formation and Stability of W/O-high Internal Phase Emulsions (HIPEs) and Derived O/W Emulsions Stabilized by PGPR and Lecithin, Food Res. Int. 2019, 122, 252-262.
-

- 20. Bui, T. N. T. V. Structure, Rheological Properties and Connectivity of Gels Formed by Carrageenan Extracted from Different Red Algae Species. Ph.D. Dissertation Le Mans Université, 2019.
- 21. Nishinari, K.; Watase, M. Effects of Sugars and Polyols on the Gel-sol Transition of Kappa-carrageenan Gels. Thermochimica Acta 1992, 206, 149-162.
-

- 22. Stenner, R.; Matubayasi, N.; Shimizu, S. Gelation of Carrageenan: Effects of Sugars and Polyols. Food Hydrocoll. 2016, 54, 284-292.
-

- 23. Goponenko, A. V.; Asher, S. A. Modeling of Stimulated Hydrogel Volume Changes in Photonic Crystal Pb2+ Sensing Materials. J. Am. Chem. Soc. 2005, 127, 10753-10759.
-

- 24. Ben-Moshe, M.; Alexeev, V. L.; Asher, S. A. Fast Responsive Crystalline Colloidal Array Photonic Crystal Glucose Sensors, Anal. Chem. 2006, 78, 5149-5157.
-

- 25. Tan, Y.; Hettiarachchi, K.; Siu, M.; Pan, Y.; Lee, A. P. Controlled Microfluidic Encapsulation of Cells, Proteins, and Microbeads in Lipid Vesicles, J. Am. Chem. Soc. 2006, 128, 5656-5658.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2022 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2023; 47(4): 463-468
Published online Jul 25, 2023
- 10.7317/pk.2023.47.4.463
- Received on Feb 23, 2023
- Revised on Apr 9, 2023
- Accepted on May 23, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Kyung Jin Lee
-
Department of Chemical Engineering and Applied Chemistry, Chungnam National University, Daejeon 34134, Korea
- E-mail: kjlee@cnu.ac.kr
- ORCID:
0000-0002-6709-3235









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.