- Preparation and Characterization of Thermal-responsive Hydrogel Using Triblock Copolymer Based on Chitosan
Department of Bioenvironmental & Chemical Engineering, Chosun College of Science and Technology, Gwangju 61453, Korea
- 키토산 기반 삼블록 공중합체를 이용한 온도감응성 하이드로젤 제조 및 특성 분석
조선이공대학교 생명환경화공과
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
This study synthesized chitosan-b-F127-b-chitosan triblock copolymer (CFC) with pluronic F127 and chitosan to increase sol-gel transition temperature. CFC triblock copolymer was synthesized by chain polymerization between F127 macromer and radical species obtained from β-1,4 glycoside bond degradation of chitosan. These physicochemical properties were analyzed by Fourier transform infrared spectroscopy (FTIR) and proton nuclear magnetic resonance (1H-NMR), which showed that CFC was successfully synthesized. The vial invert method and rheometer confirmed the sol-gel transition behavior of CFC according to temperature. As a result of observing the morphological surface of the CFC hydrogel using a field emission scanning electron microscope (FE-SEM), it was confirmed that the pore size decreased as the concentration increased. In addition, as a result of live/dead assay using human gastric adenocarcinoma (AGS) cells, it was confirmed that cells survive in CFC hydrogel, proving its potential as a cell scaffold. These results can be applied to diverse bio fields because the CFC hydrogel prepared in this study can be a scaffold that can encapsulate bioactive material into its pore.
본 연구에서는 온도 감응성 고분자 pluronic F127에 친수성인 키토산을 A-B-A 형태의 삼블록 공중합체(chitosan-b-F127-b-chitosan, CFC)로 합성하여 졸-젤 전이 온도가 증가된 하이드로젤을 제조하고자 하였다. CFC 삼블록 공중합체는 F127 macromere와 키토산 사슬의 β-1,4 glycoside bond를 분해하여 생성된 라디칼 종에 의해 합성되었다. 이들의 물리화학적 특성은 적외선 분광광도계(FTIR) 및 핵자기공명장치(1H NMR)를 이용하여 분석하였고, 이 결과를 통해 CFC가 성공적으로 합성되었음을 확인할 수 있었다. 합성된 CFC는 vial invert 방법과 레오미터를 이용하여 온도에 따른 졸-젤 전이 거동을 관찰하였다. 또한, CFC 하이드로젤의 모폴로지 표면을 주사전자현미경(FE-SEM)을 이용하여 관찰한 결과 농도가 증가함에 따라 기공 크기가 작아지는 것을 확인하였다. 또한, human gastric adenocarcinoma(AGS) cell를 이용한 live/dead assay 수행한 결과 CFC 하이드로젤에서 세포가 생존하는 것을 확인함으로써 세포 지지체로써 가능성을 입증하였다. 이러한 결과를 통해 본 연구에서 제조되어진 CFC 하이드로젤은 기공 내에 유효 생리활성 물질을 담지할 수 있는 지지체로 사용이 가능하여 바이오 분야에서 다양한 방법으로 응용될 수 있을 것으로 사료된다.
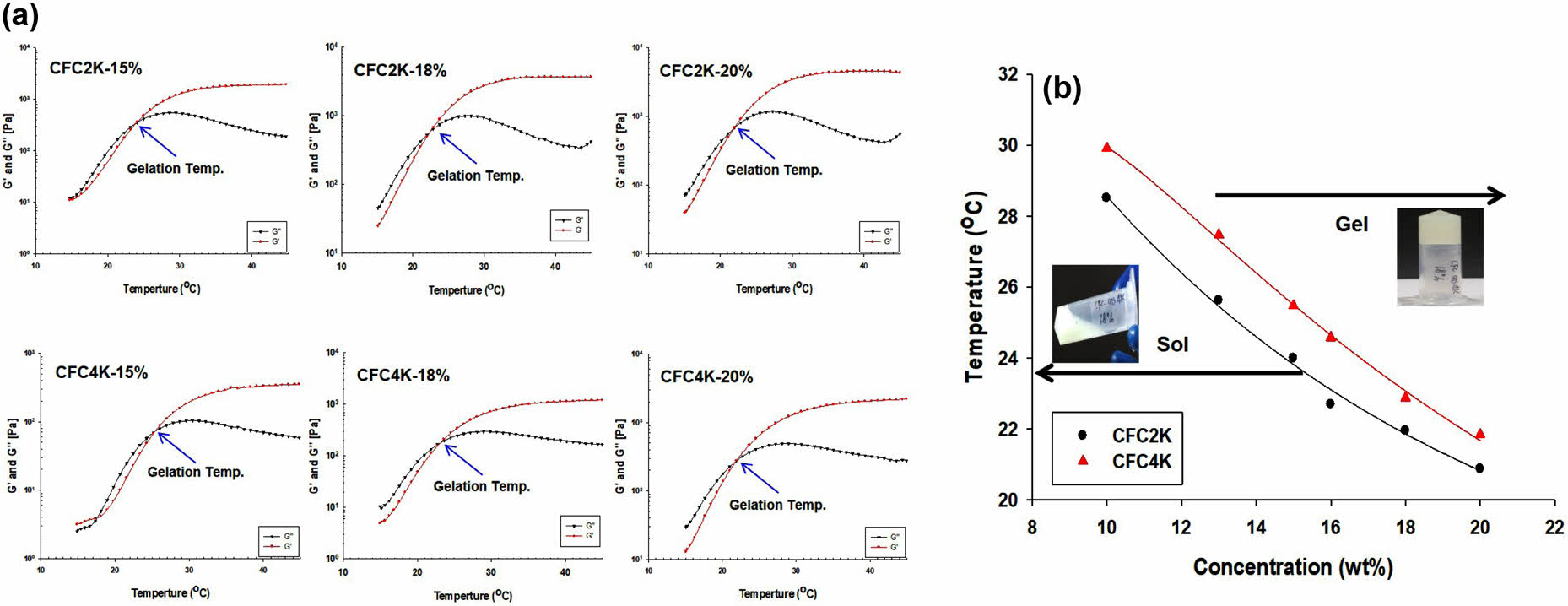
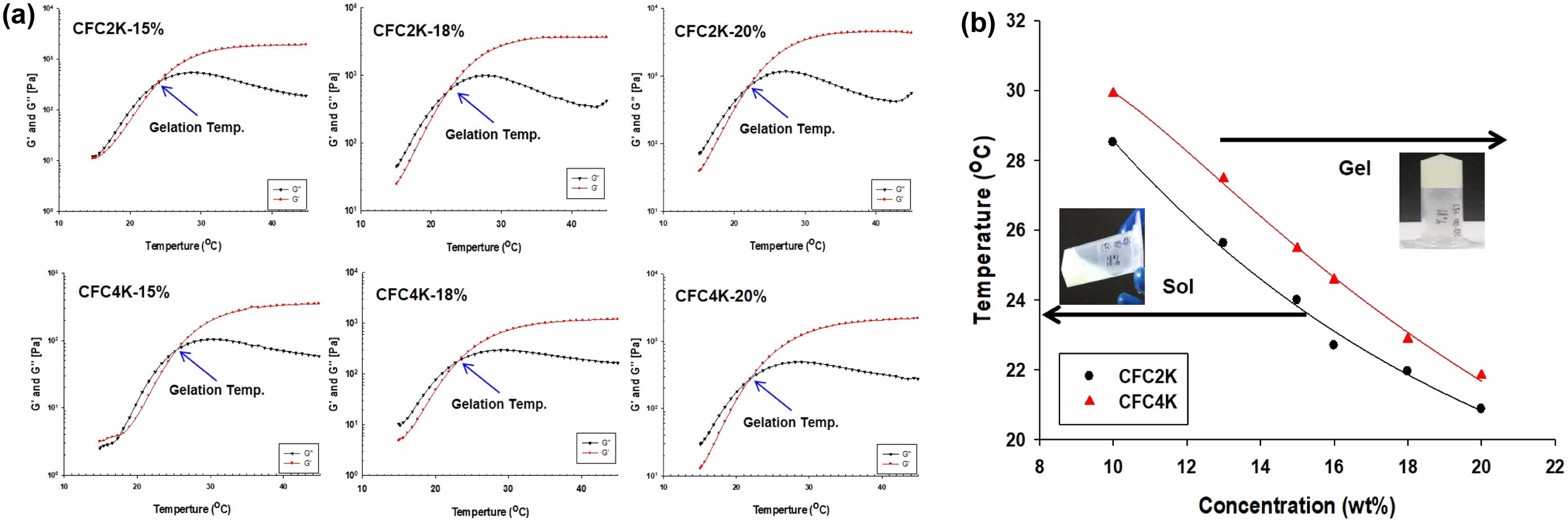
This study synthesized chitosan-b-F127-b-chitosan triblock copolymer (CFC) with pluronic F127 and chitosan to increase sol-gel transition temperature. The vial invert method and rheometer confirmed the sol-gel transition behavior of CFC according to temperature. (a) Temperature-responsive elastic (G') and viscous (G'') modulus changes of CFC2K thermosensitive hydrogels according to the concentration. (b) Sol-gel transition diagram of CFC thermosensitive hydrogels.
Keywords: chitosan, pluronic F127, triblock copolymer, thermal-responsive hydrogel, tissue engineering.
이 논문은 조선이공대학교 LINC3.0 산학공동 기술개발과제로부터 연구비를 지원받아 수행된 연구 결과물입니다.
저자는 이해상충이 없음을 선언합니다.
조직공학은 사고나 질병 등에 의해 발생된 인체 내의 결손 부위를 대체할 수 있는 지지체를 만들어 복원하는 기술이다. 최근 연구에 따르면 인체 내 결손 부위의 세포를 효과적으로 성장하게 할 수 있는 scaffold 지지체에 대한 연구가 활발히 진행 중에 있다.1 이러한 scaffold가 갖추어야 할 조건으로는 생체적합성이 우수해야 하며, 용도에 맞는 물리적 특성을 가지고 있어야 한다. 아울러, 재생에 필요한 세포가 잘 자랄 수 있도록 다공성, 낮은 세포 독성, 생분해성의 특성을 가지고 있어야 한다.1,2 Scaffold에 사용되는 재료는 생체적합성과 무독성 특성을 갖는 천연고분자와 합성고분자가 대표적이다. 천연고분자는 키토산, 콜라겐 등으로 이들은 우수한 생체적합성을 가지고 있다. 합성 고분자는 물리적 특성을 쉽게 조절할 수 있다는 장점을 가지고 있으며, poly(lactic-co-glycolic) acid(PLGA), polyglycolic acid(PGA), polylactic acid(PLA), polycapro lactone(PCL) 및 이들의 공중합체가 주로 사용되고 있다.1 Scaffold 제조 기술은 생체적합성 고분자를 성형하여 가스 발포, 염 제거 방법을 통하여 scaffold에 공극을 형성시키는 방법이 주로 사용되고 있으며, 이러한 방법을 인체 내에 적용할 때 외과적 수술, 모양의 재현성 등 문제점을 가지고 있다. 이러한 문제점을 보완하기 위해 현재는 온도 및 pH와 같은 외부 자극에 의해 졸-젤 전이 현상이 나타나는 smart hydrogel을 이용한 scaffold에 관한 연구가 진행되고 있다.3
하이드로젤은 의료용 분야에서 조직의 유착 방지, 기관/조직 재생, 의료용 충진제로부터 생리활성물질의 방출시스템 등에 사용되며, 유전자분야에서는 자극을 주는 특정 질병부위로만 치료 유전자를 전달할 수 있어서 부작용을 줄이고 치료 효율을 높일 수 있다. 또한 생체적합하고, 외과적인 수술 없이 주입이 가능하며, 목표 조직 내에 고정화됨으로써 주변 조직에 일정한 약물을 전달할 수 있는 특징 때문에 약물전달분야에서도 응용되어지고 있다.4 하이드로젤을 인체에 주입하기 위해서는 체외에서는 용액상태이고 체내에 주입 시 gel이 형성될 수 있는 재료가 요구된다. 따라서 온도 및 pH에 따라서 상변화가 수반되는 자극감응성고분자(stimuli-responsive polymer)가 smart 하이드로젤 재료로 주로 사용되고 있다.5,6
온도감응성 고분자는 특정 온도에서 성질이 바뀌는 고분자로서 대표적으로 양친성 고분자인 triblock copolymer F127, poly(L-lactic acid), poly(L-glycolic acid)와 polyethylene glycol(PEG)로 이루어진 공중합체, poly(N-isopropylacrylamide)(PNIPAM)-poly(phosphorylcholine)-poly(N-isopropylacrylamide)(PNIPAM) triblock copolymer 등이 있다. 이들 양친성 고분자 중에서 scaffold 적용 가능한 고분자 물질에는 PNIPAAm, Pluronic F127, PLGA 등이 있다. PNIPAAm은 oligo-NIPAAm, PEG를 graft하는 등 다양한 물질을 도입하여 외부 온도변화에 더 빠르게 반응하게 할 수 있지만, 생분해성이 아니라는 단점이 있다.7 또한 PLGA는 지지체로 사용함에 있어 강도와 안정성이 낮고, 분해시간이 짧다는 단점이 있다.8 이에 반해 F127은 FDA 승인을 받아 생체적합하며 생분해성의 특징을 가지고 있어 식품첨가물, 의약품 원료, 농산물 생산에서 응용되고 있다.9
온도감응성 젤을 제조하는데 가장 일반적으로 사용되는 물질인 pluronic F127(poly(ethylene oxide)-b-poly(propylene oxide)-b-poly(ethylene oxide), PEO-PPO-PEO)은 친수성인 PEO와 소수성인 PPO블록으로 구성된 양친성 triblock copolymer이다.10 F127의 친수성과 소수성 블록의 길이와 조성에 따라 전이온도를 조절하여 졸-젤 특성이 나타나지만, 약한 기계적 강도와 높은 침투성, 비분해성 등의 단점이 있다.11 이러한 단점을 보완하기 위하여 친수성 천연고분자 물질인 chitosan과 block copolymer하여 수용액 상에서 잘 용해되며, 생체적합하고 생분해성을 갖음과 동시에 F127의 졸-젤 전이 온도보다 상대적으로 높은 온도에서 졸-젤 전이 거동을 나타나게 함으로써 상온에서 사용이 용이한 온도감응성 하이드로젤을 개발하고자 한다.12
키토산은 2-amino-2-deoxy-(1,4)-β-D-glucopyranose와 N-acetyl-D-golucosamine 두 단위체로 구성되어 있는 키틴을 탈아세틸화하여 얻어지는 천연 다당류 고분자로 항균성, 면역 활성, 암전이 억제작용, 창상치유효과 등의 다양한 생리활성을 가지고 있다.13,14 또한, 생체적합성, 생분해성, 낮은 독성 및 단위체당 한개의 아민 그룹을 갖고 있어 약물 및 유전자 전달체 소재 및 조직공학과 같은 생의학 분야에서 많이 활용 되어 지고 있다.15,16
따라서 본 연구에서는 조직재생공학에 사용될 수 있는 scaffold를 Pluronic F127과 키토산을 이용하여 삼블록 공중합체를 합성하고, 이를 특정온도에서 졸-젤 전이 거동을 보이는 온도감응성 하이드로젤을 제조하여 조직재생 지지체로써 그 가능성을 규명 하고자 하였다.
시약 및 재료. 온도감응성 하이드로젤을 제조하기 위하여 사용된 pluronic F127(Mw 12.6 kDa)은 BASF사(USA)에서 구입하였다. 젖산염 키토산(Chitosan oligo saccharide, COS, Mw 2, 4 kDa)은 키토라이프에서(KITTOLIFE Co. KOREA) 구매 하였으며, F127 macromere 합성에 사용된 acryloyl chloride와 radical initiator로 사용된 potassium persulfate(KPS, K2S2O8)는 SIGMA-ALDRICH사(USA)에서 구입하여 사용하였다. Live/Dead assay 사용된 세포 AGS는 American Type Culture Collection(ATCC, KOREA)에서 분양받은 후 10%의 fetal bovine serum(FBS, gibco, USA)을 함유한 Dulbecco’s modified Eagle’s medium(DMEM, SIGMA-ALDRICH, USA)을 이용하여 배양하였다. Live/dead assay에 사용된 calcein-AM은 SIGMA-ALDRICH사(USA)에서 구매하였다. 기타 합성 및 실험에 사용된 시약과 용매는 일급 시약을 구입하여 정제하지 않고 사용하였다.
F127 Macromere 합성. F127 macromere는 F127에 acryloyl 그룹을 도입시켜 합성하였다. F127 1 g(0.00008 mol)을 컨덴서가 결합되어 있는 반응기에 넣고 dichloromethane(MC) 30 mL을 첨가하여 완전히 용해한 후 triethylamine(TEA) 65 μL(0.000646 mol)을 첨가하여 1시간 동안 교반하였고, 이에 acryloyl chloride(AC)를 29 μL(0.00032 mol)을 첨가하여 30 ℃, N2 환경에서 4시간 동안 냉각 환류장치 내에서 반응하였다. 반응 종료 후 차가운 ether에 침전 및 3회 세척을 통해 미 반응물을 제거하고 원심분리를 이용하여 상온 건조 후 F127 macromere를 회수하였다. 건조된 F127 macromere는 저분자량 반응물 및 용매 등을 완벽하게 제거하기 위하여 MWCO 10 kDa cellulose membrane를 이용하여 3차 증류수 상에서 48시간 동안 투석한 후 동결건조를 통하여 순수한 F127 macromere를 얻었다.
COS-F127-COS 삼블록 공중합체(CFC) 합성. COS2K 600 mg을 16 mL, KPS 120 mg을 4 mL의 증류수에 각각 완전히 용해한 후 COS2K 용액에 KPS 용액을 천천히 적가하여 60 ℃, N2 환경에서 1시간 동안 반응시켜 COS2K의 라디칼 종을 활성화시켰다. 이 라디칼 종 활성 반응은 KPS 양 및 반응시간에 따른 키토산 분자량의 변화 등의 최적 조건을 본 연구에 적용하였다.17 F127 macromere 3780 mg을 50 mL의 3차 증류수에 용해하여 라디칼 종이 형성된 키토산 용액에 천천히 적가한 후 상온, N2환경에서 overnight하여 합성하였다. 반응 종료 후 미 반응 COS2K 및 F127 macromere 등을 제거하기 위하여 MWCO 10 kDa cellulose membrane을 이용하여 3차 증류수 상에서 48시간 동안 투석한 후 동결 건조 시켜 최종 CFC2K를 얻었다. CFC4K 역시 위와 동일한 합성 방법을 통해 최종 물질을 얻어 본 연구에 사용하였다.
CFC의 구조적 특성 분석. CFC의 합성 유무를 확인하기 위해 구조 분석은 핵자기공명장치(1H NMR, 400 mHz, Bruker, Germany)와 적외선 분광광도계(FTIR 8700, Shimadzu, Japan)를 이용하여 분석하였다. 1H NMR 분석은 CFC 4 mg을 용매 D2O 700 mL에 용해시켜 1-10 ppm 범위에서 chemical shift를 통하여 분석하였다. FTIR 분석은 분리된 CFC와 KBr을 약 1/100(wt./wt.)의 비율로 잘 혼합하여 펠렛을 제조한 후 400-4000 cm-1 파장 범위에서 수행하여 특성 피크를 분석하였다.
온도감응성 CFC 하이드로젤 제조. 합성된 CFC는 특정 온도에서 졸-젤 전이 거동을 갖는 온도감음성 하이드로젤을 제조할 수 있는 물질이다. 졸-젤 전이 거동은 물질의 농도, 온도와 밀접한 관계가 있다. 따라서 본 연구에서는 농도에 따른 졸-젤 전이 거동을 규명하기 위하여 합성된 CFC를 PBS 7.4 용액에 농도가 15, 16, 18, 20%가 되도록 용해시켜, 냉장 보관하여 다음 실험에 사용하였다.
CFC 하이드로젤의 유변학적 특성 분석. 농도별로 제조된 CFC 용액의 졸-젤 전이 거동을 규명하기 위하여 vial invert method 방법과 rheometer(Kinexus lab+, Malvern, UK)를 이용하여 실험하였다. vial invert method는 제조되어진 용액을 15 ℃ water bath에 넣은 후 1 ℃ 간격으로 승온 시키면서 vial을 invert시켜 흐름성이 없는 상태를 gelation 온도로 측정하였다. 또한 제조되어진 용액의 유변학적 특성은 rheometer를 이용하여 분석하였다. CFC 하이드로젤을 rheometer 플레이트에 0.8 mL을 잘 펴서 올려놓은 후 1 ℃ 간격으로 승온하면서 15 ℃에서 40 ℃ 범위까지의 탄성모듈러스(G′)와 점성모듈러스(G″)를 측정하였다(프리컨시 = 2 Hz, plate 직경 = 25 mm, gap = 1 mm, 전단변형 = 0.4%). 이때 온도의 증가에 의해 나타나는 G′과 G″의 교차점을 gelation 온도로 측정하였다.
CFC 하이드로젤의 모폴로지 특성 분석. CFC hydrogel의 미세구조의 모폴로지 특성은 주사전자현미경(filed emission scanning electron microscopy, FE-SEM, HITACHI S-4800, Japan)을 이용하여 관찰하였다. 농도(15, 18, 20 wt%)에 따라서 제조된 CFC 하이드로젤을 2일간 동결 건조하여 수분을 완벽하게 제거하였다. FE-SEM 분석을 위하여 건조된 샘플의 단면을 취하여 백금으로 30초 동안 코팅하였다. 이후 단면의 형태를 가속전압 3 kV에서 다양한 배율로 관찰하여 단면 미세구조 이미지를 얻었다.
CFC 하이드로젤에서 세포의 Live/dead Assay. CFC2K와 CFC4K를 DMEM 배지에 각각 용해하여 15, 18% 용액을 제조하고, 이를 200 μL를 취해 24-well에 분주하고 겔 형성을 위해 36 ℃ incubator에서 10분간 방치 후 배양된 AGS 세포를 5 × 103 cell/well를 각각 분주하였다. 72시간 동안 각각 배양 후에 PBS로 세척 후 calcein-AM 4 μM를 처리하여 1시간 후에 형광현미경으로 세포의 생존 여부를 확인하였다.
삼블록 공중합체 CFC 합성 및 구조적 특성 분석. F127은 온도에 따라 졸-젤 전이 거동을 갖는 대표적인 물질이다. 졸-젤 전이 거동은 물질내의 친수성과 소수성의 중합도에 의해 나타나는 현상으로 친수성과 소수성의 비율을 변화시킴으로써 졸-젤 전이 온도를 바꿀 수 있다. 졸-젤 전이 거동은 온도와 물질의 농도에 대한 함수로써, F127은 20%농도, 25 ℃에서 졸-젤 전이 거동을 나타낸다. 그러나 상대적으로 낮은 온도에서 나타나는 졸-젤 전이 거동은 상온에서 컨트롤하기가 어렵다는 문제점을 갖고 있다. 따라서 본 연구에서는 F127에 친수성 그룹인 키토산을 블록공중합체의 형태로 도입함으로써 물질내의 친수성 그룹을 증가시켜 졸-젤 전이 온도를 상온에서 쉽게 제어가 가능하도록 합성 하였다.
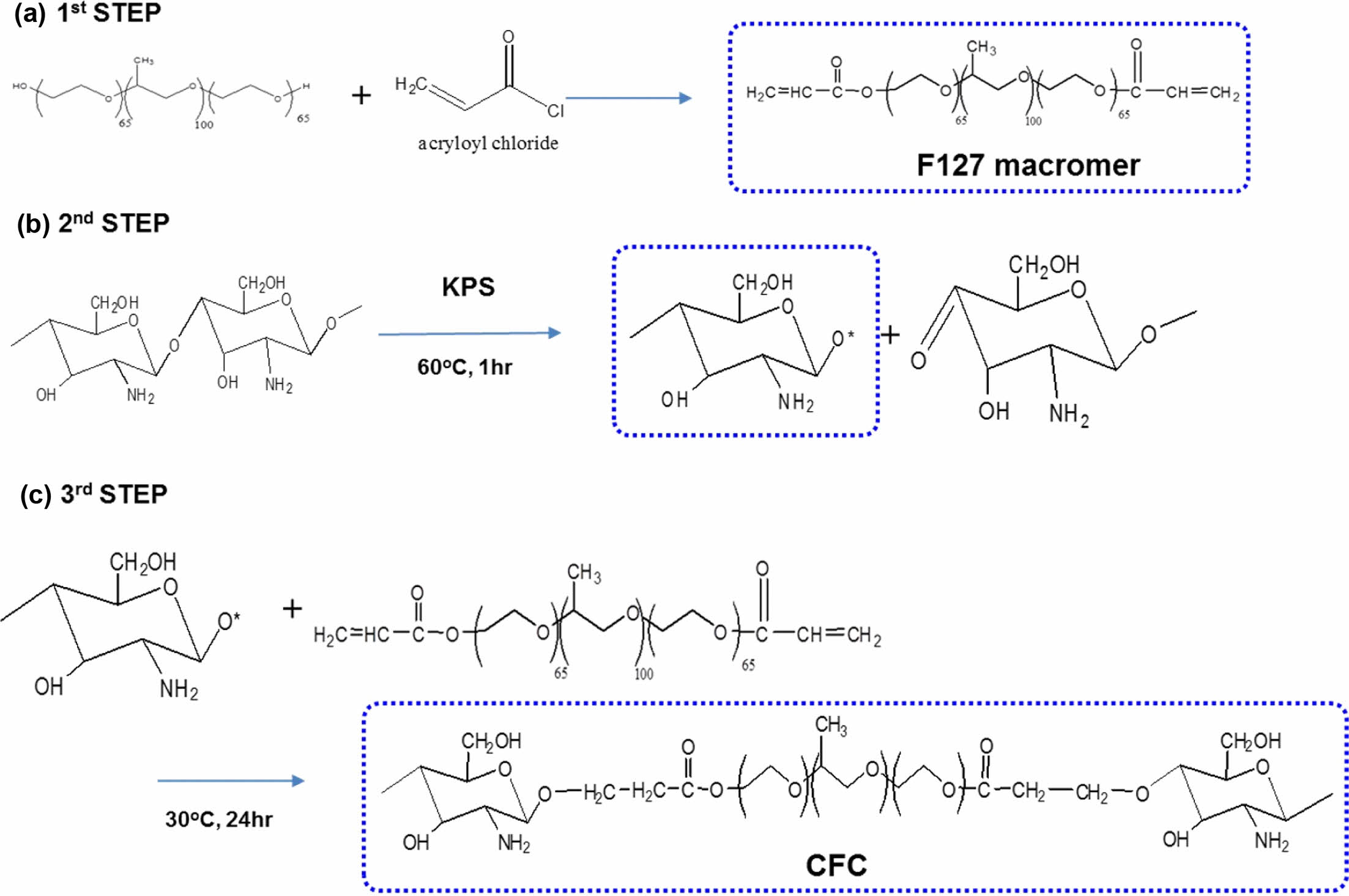
CFC를 합성하기 위하여 먼저 F127 구조내의 -OH 그룹에 acryloyl chloride를 도입시켜 이중 결합을 갖는 F127 macromere를 합성하였다(Figure 1(a)). 합성되어진 F127 macromere와 chitosan을 이용하여 A-B-A형태의 삼블록 공합체로 합성하기 위하여 KPS를 이용하여 키토산의 메인 사슬의 β-1,4 glycoside bond(-C-O-C-)를 끊고 여기에 활성 라디칼을 형성시킨 후 F127 macromere를 도입함으로써 CFC를 합성하였다(Figure 1(b,c)). 키토산 사슬이 분해됨에 따라 형성되는 라디칼 종은 KPS의 양과 반응시간에 따라 결정되고, 이는 키토산 분자량에 영향을 미치게 된다. 그 최적화된 반응공정 KPS양 및 반응시간을 본 연구에 적용하여 합성하였다.17 CFC 삼블록 공중합체의 합성 유무를 확인하기 위해 FTIR과 1H NMR을 이용하여 구조 분석을 통해 규명하였다.
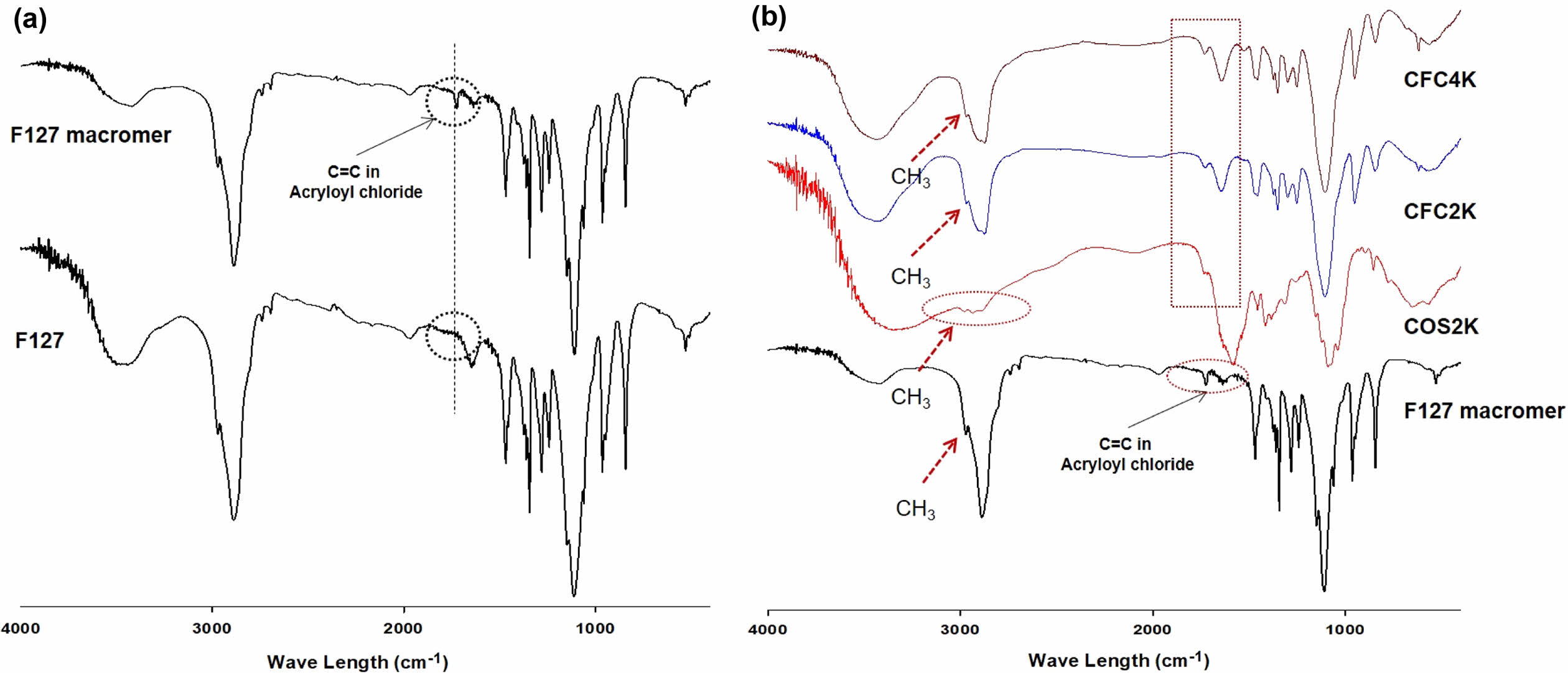
Figure 2는 FTIR를 이용하여 F127 macromere 및 CFC의 구조를 분석한 결과이다. F127의 경우 acryloyl chloride가 F127 -OH group에 도입되어 약 1800 cm-1에서 acryloyl chloride의 –C=C- 특성피크가 관찰됨으로써 F127 macromere가 성공적으로 합성되었음을 확인하였다(Figure 2(a)). 또한, CFC의 경우 라디칼 반응에 의해 acryloyl chloride에 존재하는 C=C 결합이 C-C 단일 결합으로 변화되어 1800 cm-1에서 acryloyl chloride에 C=C 특성 피크가 사라짐을 확인함과 동시에 2900-3000 cm-1에서 CH3에 의한 특성 피크가 키토산에 의해 나타나는 특성 피크와 겹쳐서 나타나는 것을 확인하였다(Figure 2(b).
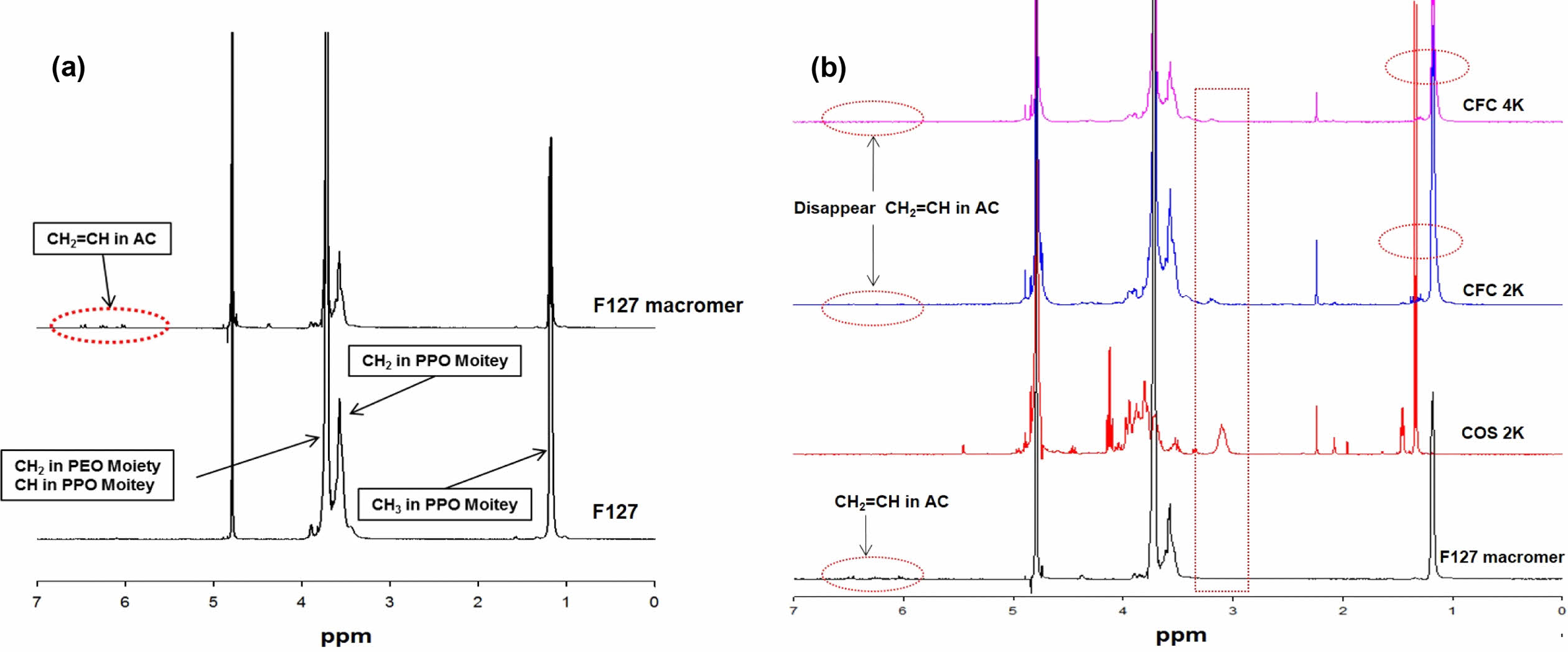
또한, Figure 3은 1H NMR을 이용하여 F127 macromere 및 CFC의 구조를 분석한 결과이다. PEO-PPO-PEO로 구성된 F127은 1.2 ppm에서 PPO의 CH3, 3.5 ppm에서 PPO의 CH2, 3.8 ppm에서 PPO의 CH 각각 수소 특성 피크를 모두 확인하였다. 또한, 3.8 ppm에서 PEO의 CH2 수소 특성 피크가 관찰되었다. F127에 acryloyl chloride가 도입된 F127 macromere의 경우 6.0-6.5 ppm에서 acryloyl chloride의 CH2=CH 수소 특성 피크가 나타나는 것을 확인하였다(Figure 3(a)). 반면에 CFC의 경우 6.0-6.5 ppm에서 acryloyl chloride의 CH2=CH 수소 특성 피크가 사라지는 것을 확인하였으며, 또한, F127에서 나타나지 않은 3.1 ppm에서 키토산의 2번 위치의 수소의 특성 피크가 CFC에서 새롭게 나타났다. 그리고 키토산에는 존재하지 않은 1.2 ppm 부근에서 F127 macromere의 수소 특성 피크를 CFC에서는 관찰할 수 있었다(Figure 3(B)). 이러한 FTIR 및 1H NMR결과를 통해 CFC 삼블록 공중합체가 성공적으로 합성되었음을 입증하였다.
CFC 하이드로젤의 졸-젤 전이 거동 및 Gelation 온도 규명. 온도감응성 하이드로젤은 수용액에서 농도와 온도에 관한 함수로써 이 조건에 의하여 졸-젤 전이 거동이 일어나며 졸-젤 전이 거동은 분자 내의 친수성/소수성 균형에 의해 나타나는 현상으로 본 연구에서는 친수성 그룹의 함량에 따른 졸-젤 전이 거동을 규명하였다. 온도감응성 하이드로젤 제조에 일반적으로 사용되는 물질은 F127로 20% 농도일 때 22-23 ℃에서 졸-젤 전이 현상이 나타난다고 보고되고 있다.18 상온에서 상 전이 제어 및 인체 조직공학 지지체로 활용하기 위해서는 이 온도가 상승되어야 할 필요가 있다. 따라서 본 연구에서는 F127에 친수성 그룹인 키토산을 블록 공중합체 형태로 도입시켜 이에 따른 졸-젤 전이 현상을 규명하였다.
본 연구에서는 키토산의 분자량(COS2, 4 kDa)에 따른 CFC를 합성하였다. 졸-젤 전이 거동을 규명하는 방법에는 vial invert method와 rheometer((Rotational) rheometer, Kinexus lab+, Malvern, UK)를 사용한 탄성모듈러스(G′)과 점성모듈러스(G″)의 변화를 관찰한 방법이 있다.
Table 1은 vial invert method로 졸-젤 전이 현상을 관찰한 결과이다. CFC2K의 경우 15%에서는 24 ℃, 그 이상의 농도에서는 22 ℃에서 졸-젤 전이 현상을 관찰할 수 있었다. 그리고 CFC4K 농도가 15%의 경우 25 ℃, 18%에서는 24 ℃, 20%에서는 22 ℃에서 졸-젤 전이 현상이 관찰되었다. 이 결과로부터 동일한 물질에서는 농도가 높을수록 상대적으로 낮은 온도에서 졸-젤 전이 현상이 나타남을 알 수 있었다. 또한 분자 구조 내 친수성 그룹의 양에 따라서 비교할 경우, 동일한 농도에서 친수성 그룹의 분자량이 클수록 졸-젤 전이 온도가 높아지는 것을 알 수 있었다.
졸-젤 전이 거동을 규명하는 방법으로 온도에 따른 탄성모듈러스(G′)과 점성모듈러스(G″)의 변화를 관찰하여 G′과 G″의 교차점을 이용하여 gelation 온도를 규명할 수 있다. 하이드로젤을 형성하는 물질의 경우 낮은 온도에서는 점성모듈러스의 영향을 많이 받으며, 온도가 상승함에 따라 탄성모듈러스의 영향을 많이 받게 된다. 온도에 따른 CFC2K, CFC4K 모듈러스의 변화를 Figure 4(a)에 각각 나타냈다. 각각의 gelation 온도의 증가에 따라서 G′과 G″의 교차점을 정확하게 확인할 수 있었으며, 농도가 높아질수록 gelation 온도가 낮아지는 것을 관찰할 수 있었다. 정확한 결과는 Table 2에 요약하였다. 결과에서 볼 수 있듯이 CFC2K의 경우 농도가 증가함에 따라서 gelation 온도가 28 ℃에서 20 ℃로 낮아졌다. 또한 CFC4K의 경우 30 ℃에서 22 ℃로 낮아지는 것을 확인할 수 있었다.
Figure 4(b)는 친수성/소수성 비율과 농도에 따른 졸-젤 전이 현상을 나타낸 결과이다. 결과에서 볼 수 있듯이 동일 물질의 경우 농도가 증가함에 따라 상대적으로 낮은 온도에서 상전이 온도를 보였다. 그리고 동일 농도에서는 친수성 그룹이 상대적으로 많은 CFC4K의 상전이 온도가 높아짐을 알 수 있었다. 이는 분자내의 키토산이 도입됨에 따라 친수성 그룹이 증가하여 gelation 온도가 증가된 것으로 사료된다.
CFC Gelation 시간 및 LCST 거동 규명. 온도감응성 하이드로젤의 경우 gelation 온도뿐만 아니라 gelation 시간도 중요한 요소 중에 하나이다. 상온에서는 액체 상태로 존재하다가 인체에 적용되었을 때 빠른 시간 내에 gelation 되어야 한다. gelation 온도가 낮고 gelation 시간이 짧을 경우 인체에 주입하는 과정에서 gelation 되어 인체에 주입할 수 없는 문제점이 있다. 또한 gelation 시간이 너무 느린 경우 인체 내에서 gelation 되지 않을 가능성이 있기 때문에 적절히 시간을 조절할 필요가 있다. 따라서 본 연구에서는 gelation 온도에서 탄성모듈러스가 최고가 되었을 때를 완벽한 gel이 형성된 것으로 판단하고 이때의 시간을 gelation 시간으로 측정하였다(Table 2). 동일 물질의 경우 농도가 높을 경우 gelation 시간이 높은 것을 확인할 수 있었다. 이는 높은 농도의 경우 친수성/소수성 균형과 소수성 상호 작용에 좀 더 많은 시간이 필요한 것으로 사료되며 친수성 그룹이 상대적으로 많은 CFC4K가 gelation 시간이 높은 것을 확인할 수 있었으며, 이는 친수성 그룹에 의한 소수성 상호작용을 감소시키기 때문인 것으로 사료된다. 이러한 결과는 gelation 온도 결과와 일치함을 확인하였다.
온도감응성 하이드로젤은 온도의 증가에 따라서 용액 점도가 증가하게 된다. 따라서 온도 상승에 따른 용액의 점도를 측정함으로써 물질의 임계하한용액온도(low critical solution temperature, LCST)를 규명하였다. 본 연구에서 합성된 CFC의 LCST는 레오미터를 이용하여 온도 증가에 따른 점도의 변화를 측정하였으며, 이 결과는 Table 2에 요약하였다. 결과에서 볼 수 있듯이 CFC2K, CFC4K 모두 약 20 ℃ 부근에서 LCST를 보였다. 동일 물질의 경우 농도가 높아질수록 LCST가 낮아 졌으며, 동일 농도의 경우 친수성 그룹이 증가할 수록 높아졌다. 이러한 결과로부터 친수성 그룹이 도입되지 않은 순수한 F127의 경우 이 온도보다 낮은 온도에서 LCST를 보일 것으로 예측할 수 있다. 이러한 연구결과를 통해 합성된 CFC는 상온에서 상 전이 제어가 유용하여 조직공학 지지체로써 활용이 가능할 것으로 사료된다.
CFC 하이드로젤의 모폴로지 특성 분석. 하이드로젤은 약물, 세포 등의 유효 생리활성 물질을 담지하고 이들을 체내에서 방출하거나 성장하게 할 수 있는 지지체 역할을 한다. 하이드로젤에 이러한 기능을 부여하기 위하여 하이드로젤의 미세구조의 기공 크기 및 발달 정도가 중요한 요소로 작용한다. 따라서 본 연구에서 합성된 CFC의 미세 구조는 FE-SEM으로 관찰하였으며, 이 결과는 Figure 5에 나타냈다. 결과에서 볼 수 있듯이 동일 물질의 하이드로젤에서는 농도가 증가함에 따라 기공의 크기가 감소하였으며, 동일 농도에서 친수성 그룹이 상대적으로 많은 CFC4K 에서 기공이 좀 더 큰 것을 관찰할 수 있었다. 이러한 결과는 농도가 증가함에 따라서 소수성 상호작용이 좀 더 강하게 나타나게 되며, 이로 인하여 미세구조가 좀 더 치밀해지기 때문이다. 또한 친수성 그룹이 상대적으로 많은 경우에는 소수성 상호작용이 상대적으로 약해지기 때문에 미세구조가 벌크해 지는 것으로 사료된다.
이러한 결과로부터, 본 연구에서 제시한 CFC는 사용 환경에 따라 CFC 종류 및 농도 등의 선택이 가능하여 다양한 분야에 적용이 가능할 것으로 사료된다.
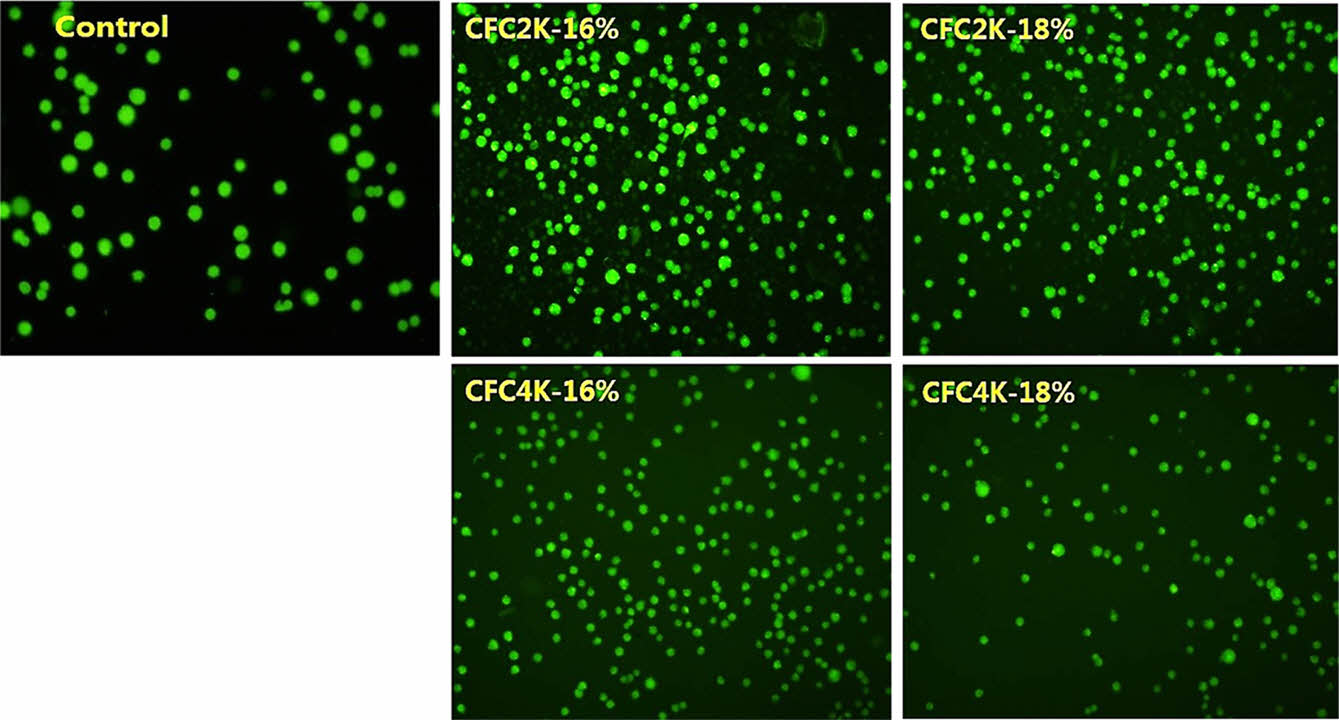
CFC 하이드로젤의 세포 Live/Dead Assay 분석. 본 연구에서 제조한 CFC2K, CFC4K 하이드로젤을 세포 전달 지지체로서 사용가능성을 확인하기 위해 calcein-AM을 이용하여 세포 생존 여부를 관찰 하였다. Figure 6에서 보여주듯이 CFC2K와 CFC4K에서 모두 control군과 유사하게 형광이 발현되는 것을 확인하였으며, 이는 세포 안으로 calcein-AM이 내포되어지고 세포안의 esterase 효소에 의해 calcein-AM이 가수분해됨으로써 형광이 발현되어 세포가 생존함을 확인할 수 있었다. 이러한 결과로 제조된 CFC 하이드로젤이 세포에 대한 독성 없이 세포 성장을 촉진시킬 수 있는 물질임을 보여 주고 있다. 좀 더 나아가, 본 연구에서 합성된 CFC 삼블록 공중합체는 하이드로젤 상에서 세포를 담지하여 전달할 수 있는 지지체로 적용 가능할 것으로 사료된다.
|
Figure 1 Syntheticscheme of triblock copolymer CFC: (a) synthesis of F127 macromer; (b,c) synthesis of CFC. |
|
Figure 2 FTIR spectra of (a) F127 macromer; (b) CFC |
|
Figure 3 1H NMR spectra of (a) F127 macromer; (b) CFC. |
|
Figure 4 (a) Temperature-responsive elastic (G') and viscous (G'') modulus changes of CFC2K thermosensitive hydrogels according to the concentration; (b) sol-gel transition diagram of CFC thermosensitive hydrogels. |

|
Figure 5 Morphological analysis of CFC according to concentration. |
|
Figure 6 Live/dead assay of CFC hydrogels after the incubated for 72 hr in AGS cell line. |
|
Table 1 Sol-Gel Transition Behavior of CFC by Vial Invert Method |

Not forming gel (×), sol-gel intermediate (△), forming gel (◎). |
|
Table 2 Rheological Properties of CFC by Rheometer |
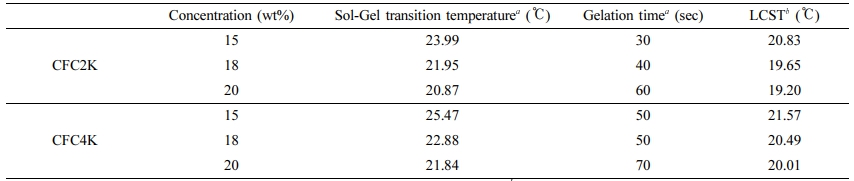
aCrossover temperature between elastic modulus (G') and viscous modulus (G''); bLCST values of CFC hydrogel were calculated by the crossover point at low temperature ranges; cNot show hydrogel forming by vial invert method. |
본 연구에서는 온도감응성 하이드로젤을 제조하기 위하여 F127과 키토산을 이용하여 삼블록 공중합체(chitosan-b-F127-b-chitosan; CFC)를 합성하였다. 하이드로젤은 분자구조내의 친수성과 소수성 그룹간의 균형 및 소수성 그룹의 상호작용에 의해 형성되어진다. 따라서 본 연구에서는 친수성 그룹인 키토산의 분자량을 변화시키면서 CFC를 합성하고, 이에 따른 온도감응성 하이드로젤의 졸-젤 전이 거동을 규명하였다.
합성된 CFC의 구조는 FTIR, 1H NMR을 이용하여 분석하여 성공적으로 합성되었음을 규명하였으며, 친수성 그룹의 분자량 및 농도에 따라서 하이드로젤을 제조하고 이들의 졸-젤 전이 거동은 vial invert 방법과 유변학적인 방법을 통하여 규명하였다. CFC의 gelation 온도는 농도가 낮고, 친수성 그룹의 분자량이 높을수록 높아지는 것을 보여주고 있으며 gelation 시간을 측정한 결과 약 1분 내에 gel이 형성되는 것을 확인하였다. 또한, CFC 하이드로젤의 모폴로지 표면 분석은 FE-SEM으로 관찰하였다. 이 결과 같은 농도에서 친수성 그룹의 비율이 다를 때, 친수성 그룹이 상대적으로 많은 CFC4K에서 기공이 좀 더 큰 것을 관찰할 수 있었으며, 동일 물질일 경우 농도가 증가함에 따라 기공의 크기가 작아지는 것을 확인할 수 있었다. 또한 live/dead assay를 통해 CFC 하이드로젤에서 세포 생존 여부를 형광현미경으로 관찰함에 따라 독성 없이 세포를 성장시킬 수 있어 조직 공학 지지체로 활용 가능성을 입증하였다. 이상의 결과로부터 본 연구에서 제조한 온도감응성 하이드로젤은 상온에서 상 전이 제어가 유용함과 동시에 친수성 비율 및 농도 변화에 따라 gelation 온도 및 시간 제어가 가능하여 다양한 생의학 분야에 적용이 가능할 것으로 사료된다.
- 1. Park, S. A.; Lee, J. H.; Kim, W. D. Development of Biomimetic Scaffold for Tissue Engineering. Elastom. Compos.2009, 44, 106-111.
- 2. Pranay Agarwal, H. W.; Zhao, S.; Xu, R. X.; Yu, J.; Lu, X.; H, X. Hyaluronic Acid-decorated Dual Responsive Nanoparticles of Pluronic F127, PLGA, and Chitosan for Targeted co-delivery of Doxorubicin and Irinotecan to Eliminate Cancer Stem-like Cells. Biomaterials 2015, 72, 74-89.
-

- 3. Shim, W. S.; Kim, J. H.; Park, H. K.; Kim, K. M.; Kwon, I. C.; Lee, D. S. Biodegradability and Biocompatibility of a pH- and Thermo-sensitive Hydrogel Formed from a Sulfonamide-modified Poly(e-caprolactone-co-lactide)–poly(ethylene glycol)–poly(e-caprolactone-co-lactide) Block Copolymer. Biomaterials 2006, 27, 5178-5185.
-

- 4. Park, C. H.; Kim, D. K. The Trend of Biomaterials in Facial Plastic and Reconstructive Surgery. Korean J. Otorhinolaryngol-Head Neck Surg. 2014, 57, 651-656.
-

- 5. Jeong, K. H.; Jung, Y. J. Preparation and Characterization of pH-sensitive Sodium Alginate/poly(vinyl alcohol)/bentonite Blend Beads. Biomater. Res. 2013, 17, 194-199.
- 6. Kopecek, J. Smart and Genetically Engineered Biomaterials and Drug Delivery Systems, Eur. J. Pharm. Sci. 2003, 20, 1-16.
- 7. Qiu, Y.; Park, K. N. Environment-sensitive Hydrogels for Drug Delivery, Adv. Drug Deliv. Rev. 2001, 53, 321-339.
-

- 8. Namgung, R.; Kim, W. J. Thermo-Responsive Polymers for Gene Delivery, Biomater. Res. 2010, 14, 86-94.
- 9. Ryu, J. H.; Lee,Y. H.; Kong, W. H.; Kim, T. G.; Park, T. G.; Lee, H. S. Catechol-Functionalized Chitosan/Pluronic Hydrogels for Tissue Adhesives and Hemostatic Materials, Biomacromolecules 2011, 12, 2653-2659.
-

- 10. Lee, J. I.; Kim, H. S.; Yoo, H. S. DNA Nanogels Composed of Chitosan and Pluronic with Thermo-sensitive and Photo-crosslinking Properties, Int. J. Pharm. 2009, 373, 93-99.
-

- 11. Shin, B. K.; Baek, E. J.; Kim, Y. T.; Jeong, J. W.; Nho, Y. C.; Lim, Y. M.; Park, J. S.; Huh, K. M.; Park, J. S. Preparation and Characterization of L-Arginine Containing Poloxamer Hydrogels for Solubilization and Sustained Release of Amphotericin B, Polym. Korea 2010, 34, 459-463.
-

- 12. Chen, X.; Zhi, F.; Jia, X.; Zhang, X.; Ambardekar, R.; Meng, Z.; Paradkar, A. R.; Hu, Y.; Yang, Y. Enhanced Brain Targeting of Curcumin by Intranasal Administration of a Thermosensitive Poloxamer Hydrogel, Royal Pharmaceutical Society. J. Pharm. Pharmacol. 2013, 65, 807-816.
-

- 13. Kim, E. H.; Jeong, J. H.; Han, G. D.; Son, T. I. Properties of Photo-Reactive Natural Polymer Derivatives and Its Applications. KIC News 2015, 18, 1-9.
- 14. Lee, D. H.; No, H. K.; Hong, J. H. Physiological Activities of Soluble Chitosan with Different Molecular Weights. J. Chitin Chitosan 2013, 18, 99-104.
- 15. Xia, W.; Liu, P.; Zhang, J.; Chen, J. Biological Activities of Chitosan and Chitooligosaccharides, Food Hydrocoll. 2011, 25, 170-179.
-

- 16. Rinaudo, M. Chitin and chitosan: Properties and applications, Prog. Polym. Sci. 2006, 31, 603-632.
- 17. Choi, C. Y.; Jeong, G. W.; Kim, S. C.; Sohn, B. K.; Hoang, T.; Giang, N. V.; Kim, M. Y.; Nah, J. W. Characterization of Degranded Chitosan Using Initiator Potassium Ersulfate. J. Sci. Technol. 2015, 53, 258-264.
- 18. Park, K. M.; Lee, S. Y.; Joung, Y. K.; Na, J. S.; Lee, M. C.; Park, K. D. Thermosensitive Chitosan–Pluronic Hydrogel as An Injectable Cell Delivery Carrier for Cartilage Regeneration. Acta Biomater. 2009, 5, 1956-1965.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2022 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2023; 47(4): 505-512
Published online Jul 25, 2023
- 10.7317/pk.2023.47.4.505
- Received on Mar 31, 2023
- Revised on May 30, 2023
- Accepted on May 30, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Gyeong-Won Jeong
-
Department of Bioenvironmental & Chemical Engineering, Chosun College of Science and Technology, Gwangju 61453, Korea
- E-mail: gwjeong@cst.ac.kr
- ORCID:
0000-0002-7020-6050










 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.