- Effect of Polyethylene Glycol (PEG) and Hydroxypropylmethylcellulose (HPMC) on the Dissolution Rate of a Sustained Release Rebamipide Tablet
College of Pharmacy, Kyungsung University, 309 Suyeong-ro, Nam-gu, Busan 48434, Korea
- 폴리에틸렌글리콜 및 히드록시프로필메틸셀룰로오스가 레바미피드 서방성 정제의 용출에 미치는 영향
경성대학교 약학대학
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
Rebamipide, an anti-gastric ulcer agent, can increase the mucosal concentration of prostaglandin and promote ulcer healing. Water-channel (WC) formers including lactose monohydrate, isomalt, mannitol, sorbitol, polyethylene glycol (PEG) 6000, and hydroxypropylmethylcellulose (HPMC) 2910 were screened for development of a matrix type, sustained-release (SR) tablet formulation of rebamipide. A wet granulation process using WC former, HPMC 2208 as a sustained-release agent, and HPC as a binder was used for manufacture of a rebamipide SR tablet. Apparent disintegration time was measured to assess the physical characterization of WC formers. A dissolution test using a USP dissolution apparatus II in pH 6.8 media was used for in vitro drug release study. Rebamipide release from SR tablets containing isomalt and sorbitol was limited, however, the dissolution test showed a significant increase with hydrophilic polymers HPMC 2910 and PEG 6000, confirming that use of hydrophilic polymers could modify the drug release rate of SR tablets.
레바미피드는 프로스타글란딘의 증가작용과 free radical의 제거작용을 통해 위점막 상해를 억제시킴으로써 위염 및 위궤양 증상을 치료하는 약물이다. 서방화 기술은 약물 방출을 긴 시간 동안 지속시켜 의약품의 효능과 복약 순응도를 증대시키는 제형화 기술이다. 본 연구에서는 레바미피드를 함유하는 서방성 정제의 약물 방출속도를 수식하기 위해 다양한 수분 경로 형성제의 사용을 검토하였다. 레바미피드와 서방화 기제인 hydroxypropylmethylcellulose(HPMC) 2208, 수분 경로 형성제로서 유당 수화물, 이소말트, 만니톨, 솔비톨, polyethylene glycol(PEG) 6000, HPMC 2910을 사용하여 습식과립공정으로 서방성 정제를 제조하였다. 용출시험을 통해 서방성 정제로부터의 약물의 방출속도를 평가하였을 때, 친수성 고분자인 PEG 6000과 HPMC 2910에 의해 서방성 정제로부터 레바미피드의 방출속도가 증가하는 결과를 나타내었다. 친수성 고분자의 사용을 통해 서방성 정제의 약물 방출속도를 효과적으로 수식할 수 있음을 확인하였다.
Water-channel (WC) formers including lactose monohydrate, isomalt, mannitol, sorbitol, polyethylene glycol (PEG) 6000, and HPMC 2910 were screened for development of a matrix type, sustained-release (SR) tablet formulation of rebamipide. The dissolution test showed a significant increase with hydrophilic polymers hydroxypropylmethgl cellulose (HPMC) 2910 and PEG 6000, confirming that the use of hydrophilic polymers could modify the drug release rate of SR tablets.
Keywords: rebamipide, sustained release, hydrophilic polymer, matrix, water channel.
저자(들)는 이해상충이 없음을 선언합니다.
위와 십이지장점막은 공격인자들과 방어인자들 사이의 균형에 의해 보전되며, 이 두 인자들 사이에 불균형이 나타날 때, 소화성 궤양(peptic ulcer)이 발생한다.1 소화성 궤양의 치료는 공격인자인 위산분비를 억제하거나 점막방어기전을 증가시킴으로써 이루어질 수 있다.2 레바미피드(rebamipide)는 위산분비에 영향을 미치지 않고 프로스타글란딘의 증가작용과 free radical의 제거작용을 통해 위점막 상해를 억제시킴으로써 위염 및 위궤양 증상을 치료하는 약물이다.3 경구투여된 레바미피드는 대부분 미변화체로 대사되며 약 10%가 뇨중으로 배설되고, 최고 혈중농도에 도달하는 시간은 1.1-2시간이며, 생물학적 반감기는 약 0.9-2시간으로 보고되고 있다.4 생체막을 이용한 흡수시험에서 보고된 레바미피드의 주요한 위장관 흡수부위는 소장과 결장이며, 흡수량은 공장에서 가장 많고, 다음으로 회장, 십이지장, 결장의 순서이다.5,6 위장관의 넓은 영역에서 흡수되는 약물은 약물의 방출시간을 연장하여 긴 시간동안 약물이 지속적으로 흡수되도록 설계한 서방성(sustained release, SR) 제형에 적합한 장점이 있다.7
SR 제형에 적용되는 약물 방출 기술은 의약품의 효능과 환자의 복약순응도 증대를 위하여 중요하게 연구되고 있다.8 SR 제형화 기술은 약물의 방출 기전에 따라 diffusion 제어 시스템, dissolution 제어 시스템, erosion 시스템, osmotic 시스템, ion-exchange 시스템 등으로 구분될 수 있으며, 형태적인 측면에서 reservoir 시스템, matrix 시스템 등으로 구분한다.9,10 Matrix 시스템은 제제내에 함유되는 약물 용량에 따른 제한이 적으며, 통상의 제조 설비를 이용하고, 대량생산을 위해 개발비용이 적고 빠르게 상용화할 수 있는 장점 등으로 선호되는 SR 제형화 기술이다.11
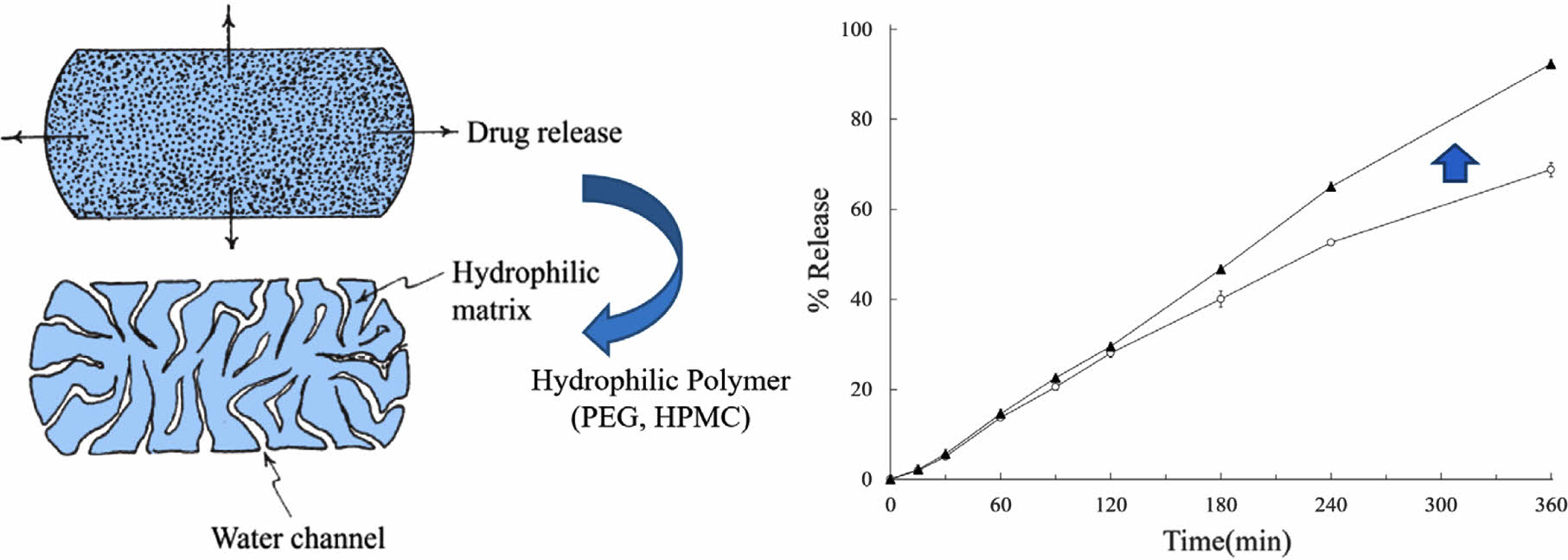
Matrix 시스템은 약물과 SR 방출 기제를 균일하게 혼합하여 제조하는 시스템으로, SR 방출 기제의 특징에 따라 erodible, non-erodible 시스템으로 구분된다. Erodible 시스템은 수용성 물질을 사용하여 약물의 방출과정에서 팽윤, 침식 등이 나타나고, non-erodible 시스템은 불활성의 소수성 물질을 사용하여 제제의 형태적 변화가 거의 관찰되지 않는다.12,13 또한, matrix 시스템에는 Figure 1과 같이 matrix 내부로 수분 또는 생체액이 침투할 수 있는 경로, 즉 수분 경로(water channel, WC)를 형성하는 수용성 물질을 첨가하여 약물의 방출속도를 수식한다.14 이러한 목적으로 사용되는 수용성 물질로는 단당류, 이당류, 당알코올(polyol) 등이 빈용되고 있다.15
본 연구에서는 레바미피드 함유 서방성 정제의 개발을 위해 matrix 시스템의 WC를 형성하는 물질로서 친수성 고분자를 사용하여 해당 고분자가 SR 정제의 용출에 미치는 영향을 확인하고, 여러 수용성 물질간의 용출특성을 비교하였다.
레바미피드를 함유하는 SR 정제는 matrix 시스템으로 설계하였다. SR 약물 방출을 위한 구성성분으로 고분자인 히드록시프로필 메틸셀룰로오스(hydroxypropylmethylcellulose, HPMC) 2208을 사용하고, 습식과립화 제조공정을 통해 수득한 과립을 압축하여 정제로 제조하였다. WC 형성을 위한 친수성 고분자로는 레바미피드와의 배합적합성을 확인한 선행연구 결과에 따라 HPMC 2910과 폴리에틸렌 글리콜(polyethylene glycol, PEG)를 사용하였다.
WC의 형성을 위해 기존 연구에서 사용되던 수용성 물질들 대비 친수성 고분자가 나타내는 약물 방출 특성을 확인하여, 궁극적으로 효과적인 SR 방출 수식을 통해 레바미피드 SR 정제의 개발이 가능하게 하고자 실험을 진행하였다.
|
Figure 1 Image showing drug release from the matrix tablets.14 |
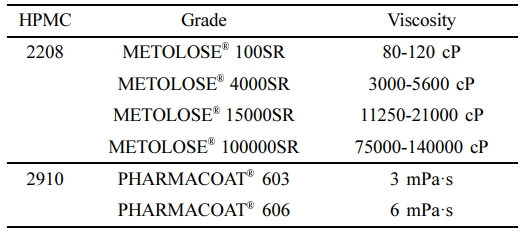
시약 및 재료. 레바미피드(100.0% purity)는 Jiangxi Synergy Pharmaceutical Co. Ltd(Jiangxi, China)에서, 유당 수화물(Pharmatose® 200M)은 DFE Pharma(Goch, Germany)에서, 이소말트(galenIQTM 720, galenIQTM 721)는 BENEO Inc. (Mannheim, Germany)에서 제공받았다. PEG 6000은 Sanyo Chemical Industries, Ltd(Kyoto, Japan)에서, PEG 20000은 DAESUNG (Busan, South Korea)에서 구입하였다. 만니톨(PEARLITOL® 400DC, PEARLITOL® 200SD) 및 솔비톨(Neosorb® P60W)은 Roquette Freres(Lestrem, France)에서 제공받았다. HPMC 2208(METOLOSE® 100SR, METOLOSE® 4000SR, METOLOSE® 15000SR, METOLOSE® 100000SR), HPMC 2910(PHARMACOAT® 603, PHARMACOAT® 606)은 Shin-Etsu Co., Ltd(Tokyo, Japan)에서 제공받았다. Hydroxypropyl cellulose(HPC)은 Nippon Soda Co., Ltd(Tokyo, Japan)에서, colloidal silicon dioxide(Aerosil® 200 Pharma)는 Evonik Corp. (Essen, Germany)에서, magnesium stearate는 FACI(Genoa, Italy)에서 구입하였다. 실험에서 사용된 모든 용매 및 화학약품은 high performance liquid chromatography(HPLC) 등급을 사용하였다.
서방화 고분자의 팽윤 특성분석. 약물 방출을 서방화하기 위한 고분자인 HPMC 2208을 사용하여 matrix 시스템의 정제를 설계하였다. 레바미피드 SR 정제에 사용할 고분자를 선정하기 위하여 4종류의 HPMC 2208의 팽윤성을 비교하였다. 각각의 HPMC 2208에 2.5%(w/w)의 농도가 되도록 magnesium stearate를 넣어 혼합한 후, 혼합물을 60호체로 체과하여 단발식 타정기(XENA-1, RAONXENA, South Korea)를 사용하여 정제의 중량이 205 mg이 되도록 직경 8 mm의 원형 펀치로 타정하였다. 제조한 정제는 팽윤성을 확인하기 위하여 USP dissolution apparatus II(Vision Classic 6; Hanson dissolution tester, USA)를 이용한 용출시험에서 0.5, 1, 1.5, 2, 3, 4, 6, 8, 10, 12시간에 정제의 두께를 측정하였다. 용출기는 Vision Classic 6(Hanson dissolution tester, USA)을 사용하였으며, 회전 수는 50 rpm, 용출액의 온도는 37±0.5 ℃, 용출액은 인공장액(pH 6.8) 900 mL로 설정하였다.
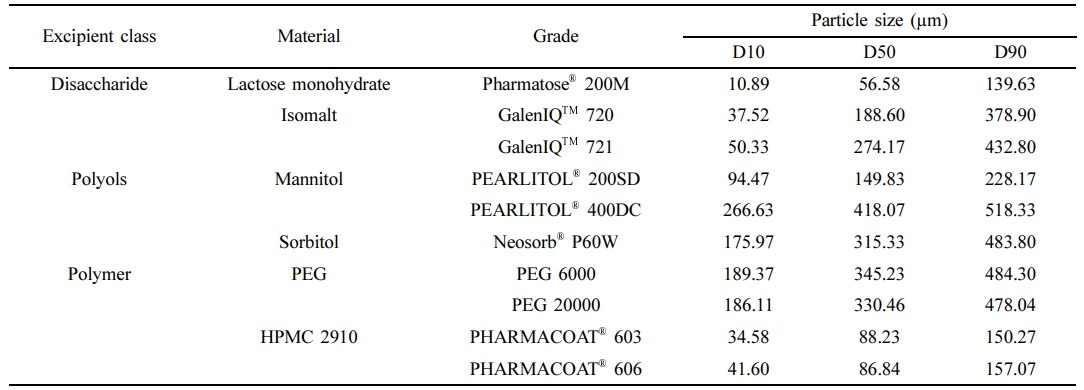
입자크기 측정. 본 실험에서는 레바미피드 SR 정제의 약물 방출속도를 수식하는 WC 형성제로서 이당류인 유당 수화물, 이소말트, 당알코올인 만니톨, 솔비톨, 친수성 고분자인 HPMC 2910, PEG를 사용하였다. 각각의 WC 형성제를 30호체를 사용하여 체과한 후 레이저 입도분석기(LS 13 320 XR, BECKMAN COULTER, USA)를 이용하여 건식상태에서 입자크기를 측정하였다.
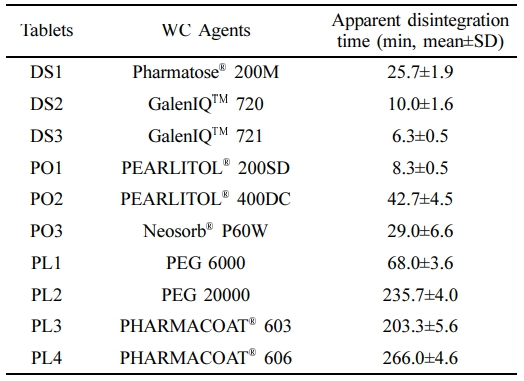
겉보기 붕해속도 측정. 입자크기분포 측정에 사용된 WC 형성제의 상대적인 용해속도를 비교하기 위하여 겉보기 붕해시간을 측정하였다. 각각의 WC 형성제에 2.5%(w/w)의 농도가 되도록 magnesium stearate를 넣어 혼합한 후, 혼합물을 60호체로 체과한 이후 단발식 타정기를 사용하여 정제의 중량이 205 mg이 되도록 직경 8 mm의 원형 펀치로 타정하였다. 제조한 정제의 겉보기 붕해시간을 확인하기 위하여 USP dissolution apparatus II를 이용한 용출시험에서 시험 개시 후 정제가 붕해하여 완전히 사라지는 시간을 측정하였다. 용출기의 시험조건은 50 rpm, 37±0.5 ℃이며 용출액은 인공장액(pH 6.8) 900 mL를 사용하였다.
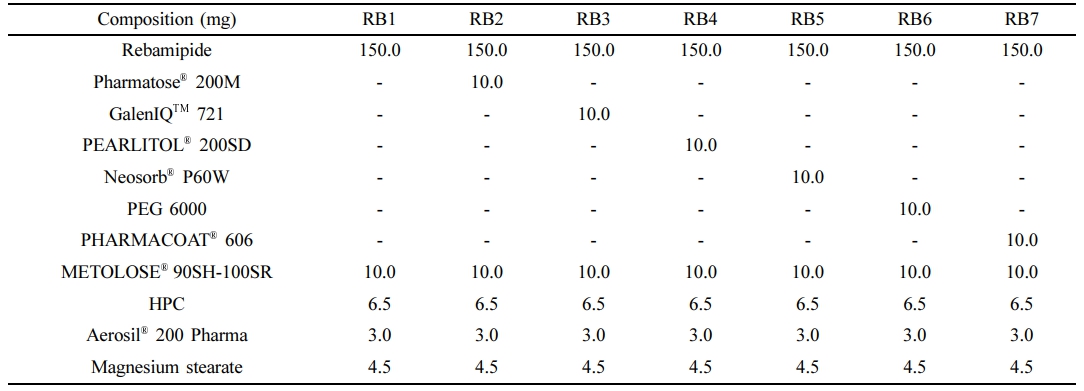
SR 정제의 제조. 레바미피드를 함유하는 과립의 제조는 Table 1의 조성으로 습식과립화 공정으로 제조하였다. 모든 재료들은 60호체를 사용하여 체과한 후 사용하였다. 레바미피드와 HPMC 2208, WC 형성제를 혼합한 후 혼합물에 HPC 용액을 넣어 연합하고 이후 16호체를 사용하여 제립하였다. 제립물은 50 ℃에서 건조감량(loss on drying)이 2% 이하가 되도록 건조한 후 20호체로 정립하고 이후 colloidal silicon dioxide, magnesium stearate를 넣고 Y-mixer(ERWEKA YB5, Germany)로 활택하였다. 활택물은 단발식 타정기에서 직경 8 mm, 경도 7.5±1 kp의 원형 정제로 타정하였다. 모든 과립과 정제는 1000정의 규모로 제조하였다.
SR 정제의 방출양상. 제조한 SR 정제로부터 방출되는 레바미피드의 방출양상은 USP dissolution apparatus II를 이용한 용출시험으로 평가하였다. 용출기의 시험조건은 50, 100 rpm, 37±0.5 ℃이며 용출액은 인공장액(pH 6.8) 900 mL를 사용하였다. 용출시험 검체는 용출액을 채취하여 PVDF 재질의 0.45 μm 필터(Millipore, USA)로 여과한 후 HPLC(Agilent 1200 series, USA)로 분석하였다. 용출시험 검체에서의 레바미피드의 용출률은 표준품을 이용한 검량선을 통해 산출하였으며, 시간-용출률의 그래프를 작성하였다.
서방화제 함유 정제의 팽윤특성. 레바미피드 함유 matrix 시스템의 서방화를 위해 Table 2와 같이 다양한 점도의 HPMC 2208를 사용하였다. 제조한 정제의 팽윤특성을 평가하였을 때, Figure 2와 같이 4종류의 HPMC 2208의 정제 모두 수성 용매와 접촉하여 그 크기가 증가하는 것을 확인할 수 있었다. 12시간의 용출과정동안 METOLOSE® 100SR을 사용한 정제는 3시간 시점에서 가장 크게 팽윤한 이후 크기가 감소하여 12시간에는 모두 붕해되었으며, METOLOSE® 4000SR, 15000SR, 100000SR을 사용한 정제는 12시간까지 크기의 증가가 관찰되었다. Table 2에서 제시한 HPMC 2208의 점도와 이를 사용하여 제조한 정제의 팽윤 특성을 비교할 때, SR 정제에 사용된 HPMC 2208의 점도가 증가할수록 정제의 두께가 비례하여 증가하였다.16 팽윤성은 친수성 고분자가 수화되어 hydrogel을 형성하는 과정에서 관찰되며, HPMC matrix 정제의 팽윤성은 약물 방출에 영향을 미치는 주요한 물리적 특성으로 보고되고 있다.17 따라서, 약물 방출속도는 METOLOSE® 100SR를 사용한 정제에서 가장 빠르고, METOLOSE® 100000SR를 사용한 정제에서 가장 느릴 것으로 예측된다.
WC 형성제의 입자크기분포. WC 형성제의 입자크기는 Table 3과 같이 유당 수화물이 가장 작은 입자크기를 나타내었으며, 만니톨인 PEARLITOL® 400DC가 가장 큰 것으로 확인되었다. 친수성 고분자 중 2종의 PEG는 입자크기가 서로 유사하였으며, 2종의 HPMC 2910도 입자크기가 서로 유사한 것으로 확인되었다.
겉보기 붕해속도. 다양한 WC 형성제를 사용하여 제조한 정제의 겉보기 붕해시간을 측정한 결과는 Table 4와 같다. 이당류인 GalenIQTM 721를 사용한 DS3이 가장 빠른 겉보기 붕해시간을 나타내었으며, 친수성 고분자인 PHARMACOAT® 606을 사용한 PL4가 가장 느린 겉보기 붕해시간을 나타내었다. 만니톨을 사용하여 제조한 PO1과 PO2의 겉보기 붕해시간을 비교할 때PO1이 더 빠른 시간을 나타내었다. PO1의 빠른 겉보기 붕해시간은 PEARLITOL® 200S 보다 입자크기가 작은 PEARLITOL® 400DC이 더 넓은 표면적을 갖고 이로 인해 용매와 접촉 시 더 빠르게 용해하여 나타난 결과로 보인다.18
이소말트를 사용하여 제조한 DS2와 DS3의 겉보기 붕해시간을 비교할 때, 입자크기가 큰 GalenIQTM 721를 사용한 DS3의 겉보기 붕해시간이 GalenIQTM 720를 사용한 DS2보다 빠른 것으로 나타났다. 이소말트의 구성성분은 1-0-α-D-Glucopyranosyl-D-mannitol dehydrate(GPM)과 6-0-α-D-Glucopyranosyl-D-sorbitol(GPS)이며, GalenIQTM 721은 GPM과 GPS의 비율이 1:3이고, GalenIQTM 720은 1:1이다. GalenIQTM 721과 GalenIQTM 720의 수용해도(20 ℃)는 각각 0.42 g/mL, 0.25 g/mL로 GPS의 비율이 높은 GalenIQTM 721의 수용해도가 GalenIQTM 720보다 높다. 이러한 높은 수용해도에 의해 DS3의 겉보기 붕해시간이 DS2보다 빠르게 나타난 것으로 판단할 수 있다.19
고분자인 PEG를 사용하여 제조한 PL1과 PL2의 겉보기 붕해시간을 비교할 때, Table 5와 같이 낮은 점도의 PEG 6000을 사용하여 제조한 PL1이 높은 점도의 PEG 20000을 사용하여 제조한 PL2 보다 빠른 겉보기 붕해시간을 나타내었다. HPMC 2910을 사용하여 제조한 정제의 겉보기 붕해시간도 낮은 점도의 PHARMACOAT® 603을 사용하여 제조한 PL3이 PL4보다 빠른 것을 확인할 수 있었다. 고분자의 점도가 정제의 겉보기 붕해시간에 큰 영향을 미치고 있음을 확인할 수 있었다.
SR 정제의 방출양상. 레바미피드 SR 정제는 erodible 시스템으로 설계하기 위하여 팽윤 특성분석에서 팽윤 이후 침식작용으로 정제의 붕해가 12시간 이내에 완료한 METOLOSE® 100SR를 서방화 고분자로 선정하였다. 또한, METOLOSE® 100SR은 고점도의 HPMC 2208 대비 수용매와 접촉 시 빠르게 수화되어 균일하고 연속적인 gel layer를 형성하는 것으로 보고되고 있다.20
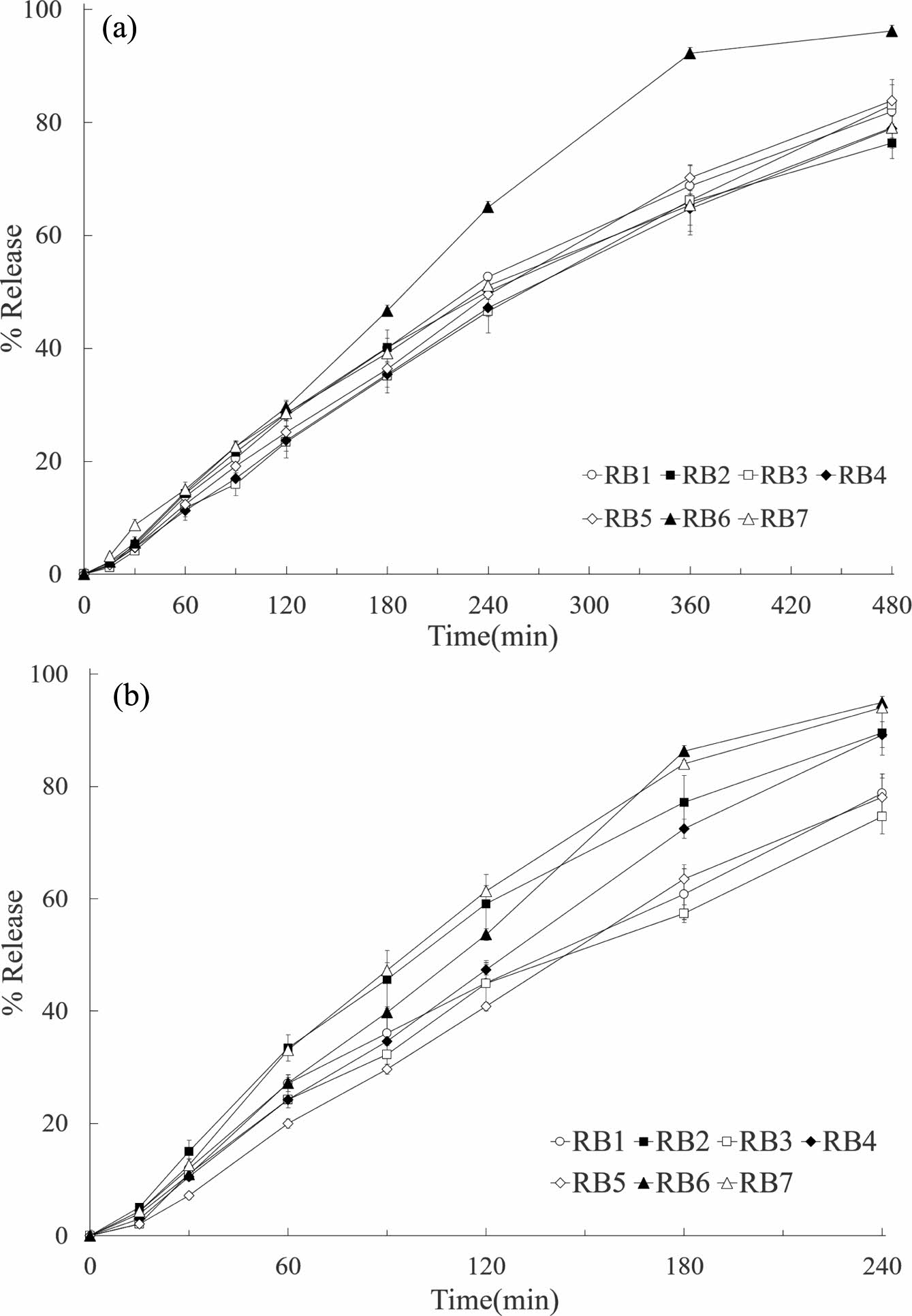
SR 정제의 용출시험은 레바미피드의 흡수량이 많은 소장 영역의 생체액과 유사한 인공 장액을 사용하여 진행하였다. 제조한 레바미피드 SR 정제를 용출시험하였을 때, WC 형성제가 포함되지 않은 RB1은 Figure 3(a)과 같이 50 rpm의 교반조건에서 480분동안 80% 이상의 레바미피드를 서방출하였다. WC 형성제가 포함된 SR 정제 중 PEG 6000을 함유한 RB6은 용출 후 300분동안 80% 이상의 레바미피드를 방출하여 가장 빠른 용출속도를 나타내었으며, RB6을 제외한 SR 정제들은 모두 유사한 방출양상을 나타내었다.
경구용 제제의 용출시험에서 50 rpm과 함께 널리 활용되는 100 rpm의 조건으로 240분동안 SR 정제를 시험한 결과는 Figure 3(B)와 같다. 100 rpm의 교반조건에서 확인된 SR 정제의 용출속도는 50 rpm의 교반조건보다 증가하는 것으로 나타났다.21 50 rpm의 교반조건에서 가장 빠른 용출속도를 나타낸 RB6이 100 rpm에서도 가장 빠른 것으로 확인되었으며, WC 형성제로 GalenIQTM 721, Neosorb® P60W를 사용한 RB3과 RB5는 WC 형성제를 사용하지 않은 RB1보다 레바미피드의 방출량(240분)이 작은 것으로 나타났다. 또한, Pharmatose® 200M, Neosorb® P60W, PHARMACOAT® 606을 사용한 RB2, RB4, RB7의 방출량(240분)은 WC 형성제가 포함되지 않은 RB1보다 큰 것으로 나타났다. 즉, SR 정제의 방출속도가 증가함에 따라 WC 형성제인 유당 수화물, 만니톨, HPMC 2910의 영향은 증가하는 것으로 나타났으나, 이소말트와 솔비톨은 모든 교반조건에서 SR 정제의 방출속도에 영향을 미치는 않는 것으로 확인되었다.
WC 형성제를 사용하여 제조한 정제의 겉보기 붕해시간을 측정하였을 때, GalenIQTM 721, PEARLITOL® 200SD, Pharmatose® 200M, Neosorb® P60W, PEG 6000, PHARMACOAT® 606의 순서로 겉보기 붕해시간이 증가하였다. PEG 6000, PHARMACOAT® 606은 겉보기 붕해시간이 크게 나타났지만, PEG 6000은 모든 교반속도에서 방출량을 크게 증가시켰으며 PHARMACOAT® 606은 100 rpm의 교반조건에서 PEG 6000 다음으로 방출량을 크게 증가시켰다. PEG와 HPMC는 난용성 약물의 가용화에 빈용되는 친수성 고분자이다.22,23 본 실험에서 PEG와 HPMC는 WC 형성제로서 matrix 시스템의 내부에 존재하는 약물의 방출을 용이하게 하는 동시에 가용화제로 작용하여 주변 물질의 용해도를 증진시켜 SR 정제의 약물 방출을 크게 증가시킨 것으로 사료된다. 이러한 결과는 SR 정제의 약물의 방출속도를 증가시키고자 WC 형성제를 검토하는 경우, 도입하는 물질의 용해도와 함께 그 물질이 나타내는 가용화 효과를 중요하게 고려해야 함을 시사한다.
레바미피드 SR 정제의 방출거동을 확인하기 위하여 용출 종료시점(80% 이상)까지의 SR 정제의 시간에 따른 약물 방출률(%)을 이용하여 직선식에 대한 결정계수(coefficient of determination, R2)를 산출하였다. PEG가 사용된 RB6는 50 rpm에서 0.9982이고 100 rpm에서 0.9971으로 SR 정제 중 가장 높은 값을 나타내었으며, SR 방출거동이 0차 속도를 따르는 것으로 확인되었다.24 반면, 유당 수화물이 사용된 RB2는 결정계수가 0.9666(50 rpm), 0.9668(100 rpm)으로 가장 낮은 값을 나타내었다.

|
Figure 2 Photographs of HPMC 2208 tablets during dissolution test. |
|
Figure 3 Dissolution profiles of rebamipide from different SR tablet formulations (RB1-RB7) at (a) 50 rpm; (b) 100 rpm. The experiment was conducted in USP Apparatus 2 in dissolution media maintained at 37.0 ℃. Each value reprsents the mean ± standard deviation (n = 6). |
본 연구에서는 레바미피드를 함유하는 SR 정제의 방출속도 수식을 위해 친수성 고분자를 포함한 다양한 WC 형성제의 사용을 검토하였다. 레바미피드 SR 정제는 서방화 기제인 HPMC 2208과 함께 다양한 종류의 WC 형성제를 사용하여 습식과립법으로 과립을 제조한 후 정제로 압축성형하였다.
다양한 점도의 HPMC 2208를 사용하여 경시적 팽윤거동을 관찰하였을 때, METOLOSE® 100SR은 erodible 시스템에 적합한 팽윤과 침식이 관찰되었다. 다양한 WC 형성제의 물리적 특성을 평가하기 위하여 각각의 입자크기를 측정하고, WC 형성제가 사용된 정제의 겉보기 붕해시간을 측정하였다. 겉보기 붕해시간은 WC 형성제의 입자크기에 비례하였으며, 용해도와는 반비례하는 관계임을 확인할 수 있었다. 약물의 방출속도에 대한 WC 형성제의 영향은 SR 정제의 용출시험을 통해 평가하였다. 용출시험에서 교반속도가 빠를 때 WC 형성제가 SR 정제의 약물 방출속도에 미치는 영향이 크게 나타났으며, 친수성 고분자인 PEG 6000과 PHARMACOAT® 606의 사용으로 SR 정제의 약물 방출속도가 증가하는 것을 확인하였다. 특히, PEG 6000을 사용한 정제는 모든 교반속도에서 약물 방출속도를 증가시키고 0차 속도를 따르는 방출거동을 나타내었다.
따라서, 친수성 고분자의 사용을 통해 matrix 시스템의 약물 방출속도를 수식하고, 궁극적으로 0차 속도를 따르는 레바미피드 SR 정제를 개발할 수 있음을 확인하였다.
- 1. Shay, H. Etiology of Peptic Ulcer Disease. Am. J. Digest. Dis. 1961, 6, 29-49.
- 2. Bright-Asare, P. Treatment of Duodenal Ulcer with Enprostil, a Prostaglandin E2 Analogue. Am. J. Med. 1986, 18, 64-68.
-

- 3. Naito, Y.; Yoshikawa, T.; Iinuma, S.; Miyazaki, R.; Yoshida, N.; Osumi, T.; Hirao, Y.; Kondo, M. Local Gastric and Serum Concentrations of Rebamipide following Oral Administration to Patients with Chronic Gastritis. Arzneim, Forsch. Drug Res. 1996, 46, 698-700.
- 4. Shioya, Y.; Shimizu, T. High-performance Liquid Chromatographic Procedure for the Determination of a New Antigastric Ulcer agent, 2-(4-Chlorobenzoylamino)-3-[2(1H)-Quinolinon-4-yl]Propionic Acid, in Human Plasma and Urine. J. Chromatogr. 1988, 434, 283-287.
-

- 5. Huang, B.; Li, G.; Luo, J.; Duan, L.; Nobuaki, K.; Akira, Y. Permeabilities of Rebamipide via Rat Intestinal Membranes and Its Colon Specific Delivery Using Chitosan Capsule as a Carrier. World. J. Gastroenterol. 2008, 14, 4928-4937.
-

- 6. Markovic, M.; Zur, M.; Dahan, A.; Cvijić, S. Biopharmaceutical Characterization of Rebamipide: The Role of Mucus Binding in Regional-dependent Intestinal Permeability. Eur. J. Pharm. Sci. 2020, 152, 105440.
-

- 7. Rouge, N.; Buri, P.; Doelker, E. Drug Absorption Sites in the Gastrointestinal Tract and Dosage Forms for Site-specific Delivery. Int. J. Pharm. 1996, 136, 117-139.
-

- 8. Chien, W. Y. Potential Development and New Approaches in Oral Controlled-Release Drug Delivery Systems. Drug Dev. Ind. Pharm. 2008, 9, 1291-1330.
-

- 9. Grassi, M.; Grassi, G. Application of Mathematical Modeling in Sustained Release Delivery Systems. Expert Opin. Drug Deliv. 2014, 11, 1299-1321.
-

- 10. Sousa, A.; Serra, J.; Estevens, C.; Costa, R.; Ribeiro, A. A Quality by Design Approach in Oral Extended Release Drug Delivery Systems: Where We Are and Where We Are Going? J. Pharm. Investig. 2023, 53, 269-306.
-

- 11. Gao, Y.; Gesenberg, C.; Zheng, W. Developing Solid Oral Dosage Forms; Academic Press: London, 2017.
-

- 12. Bermejo, M.; Sanchez-Dengra, B.; Gonzalez-Alvarez, M.; Gonzalez-Alvarez, I. Oral Controlled Release Dosage Forms: Dissolution versus Diffusion, Expert Opin. Drug Deliv. 2020, 17, 791-803.
-

- 13. Song, S. H.; Chae, B. R.; Sohn, S. I.; Yeom, D. W.; Son, H. Y.; Kim., J. H.; Kim, S. R.; Lee, S. G.; Choi, Y. W. Formulation of Controlled-release Pelubiprofen Tablet Using Kollidon SR. Int. J. Pharm. 2016, 511, 864-875.
-

- 14. Sinko, P. Martin’s Physical Pharmacy and Pharmaceutical Sciences 8th Edition; LWW: Philadelphia, 2023.
- 15. Lamoudi, L.; Chaumeil, J. C.; Daoud, K. Swelling, Erosion and Drug Release Characteristics of Sodium Diclofenac from Heterogeneous Matrix Tablets. J. Drug Deliv. Sci. Technol. 2016, 31, 93-100.
-

- 16. Sheskey, P. J.; Hancock, B. C.; Moss, G. P.; Goldfarb, D. J. Handbook of Pharmaceutical Excipients 9th Edition; Pharmaceutical Press: London, 2020.
- 17. Losi, E.; Peppas, N. A.; Ketcham, R. A.; Colombo, G.; Bettini1, R.; Sonvico, F.; Colombo, P. Investigation of the Swelling Behavior of Dome Matrix Drug Delivery Modules by High-resolution X-ray Computed Tomography. J. Drug Del. Sci. Tech. 2013, 23, 165-170.
-

- 18. Leleux, J.; Williams, R. O. Recent Advancements in Mechanical Reduction Methods: Particulate Systems. Drug Dev. Ind. Pharm. 2013, 40, 289-300.
-

- 19. BENEO GmbH. Technical literature: Isomalt, galenIQ; BENEO GmbH: Mannheim, 2019.
- 20. Williams, H. D.; Ward, R.; Culy, A.; Hardy, I. J.; Melia, C. D. Designing HPMC Matrices with Improved Resistance to Dissolved Sugar. Int. J. Pharm. 2010, 401, 51-59.
-

- 21. Costa, P.; Lobo, J. M. S. Influence of Dissolution Medium Agitation on Release Profiles of Sustained-Release Tablets. Drug. Dev. Ind. Pharm. 2001, 27, 811-817.
-

- 22. Mitchell, S. A.; Reynolds, T. D.; Dasbach, T. P. A Compaction Process to Enhance Dissolution of Poorly Water-soluble Drugs Using Hydroxypropyl Methylcellulose. Int. J. Pharm. 2003, 250, 3-11.
-

- 23. Heo, M.; Piao, Z.; Kim, T.; Cao, Q.; Kim, A.; Lee, B. Effect of Solubilizing and Microemulsifying Excipients in Polyethylene Glycol 6000 Solid Dispersion on Enhanced Dissolution and Bioavailability of Ketoconazole. Arch. Pharm. Res. 2005, 5, 604-611.
-

- 24. Chidambaram, N.; Porter W.; Flood, K.; Qiu, Y. Formulation and Characterization of New Layered Diffusional Matrices for Zero-order Sustained Release. J. Control. Release. 1998, 52, 149-158.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2022 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2024; 48(1): 53-59
Published online Jan 25, 2024
- 10.7317/pk.2024.48.1.53
- Received on Sep 6, 2023
- Revised on Oct 18, 2023
- Accepted on Oct 20, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Seh Hyon Song
-
College of Pharmacy, Kyungsung University, 309 Suyeong-ro, Nam-gu, Busan 48434, Korea
- E-mail: shsong@ks.ac.kr
- ORCID:
0000-0001-8028-2121











 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.