- Effect of Fluorine Substitution on the Physical and Optical Characteristics of BDT-ttTPD Copolymers for Organic Semiconductors
Seungju Kim# , Jin Soo Yoo*,#, Junghoon Lee*,†
 , and Kyu Cheol Lee†
, and Kyu Cheol Lee† 
Department of Applied Chemistry·Food Science Technology, Dong-Eui University, 176 Eomgwangro, Busan 47340, Korea
*Division of Chemical Engineering, Dongseo University, Busan 47011, Korea- 유기반도체용 BDT-ttTPD 공중합체의 불소 치환이 물리적, 광학적 특성에 미치는 영향
동의대학교 응용화학·식품공학과, *동서대학교 화학공학부
Reproduction, stored in a retrieval system, or transmitted in any form of any part of this publication is permitted only by written permission from the Polymer Society of Korea.
This study aimed to investigate the physical and chemical properties resulting from the introduction of fluorine substituents in two copolymers, namely PBDTT-ttTPD and PFBDTT-ttTPD, which were synthesized using benzodithiophene (BDT) as donor and alkylthienothienyl thienopyrrolodione (ttTPD) as acceptor. In comparison to PBDTT-ttTPD, PFBDTT-ttTPD demonstrated low HOMO energy levels (-5.51 eV) and high thermal stability. Furthermore, DFT calculations provided predictions for molecular arrangement and electron distribution, which tend to be similar to experimental results, meaning these results can be used as materials for new organic semiconductors.
본 연구에서는 전자 주개 물질인 benzodithiophene(BDT)와 전자 받개 물질인 alkylthienothienyl thienopyrrolodione (ttTPD)를 Stille 커플링 중합법으로 2가지 유기반도체용 공중합체인 PBDTT-ttTPD와 PFBDTT-ttTPD를 합성하고 불소 치환기 도입에 따른 물리적 및 화학적 특성을 확인하였다. PBDTT-ttTPD에 비해 PFBDTT-ttTPD가 더 낮은 HOMO 레벨과 높은 열안정성을 보여 주었다. 또한 DFT 계산으로부터 분자간 배열 및 전자 분포를 예측하였으며 이 값은 실험적 결과들과 유사한 경향성을 보이며 이런 결과는 새로운 유기반도체용 재료로써 활용 가능함을 의미한다.
Two new D-A type conjugated copolymers consisting of BDTT and ttTPD were synthesized via Stille coupling polymerization. In comparison to PBDTT-ttTPD, PFBDTT-ttTPD exhibited low highest occupied molecular orbital energy levels and high thermal stability.
Keywords: conjugated polymer, fluorine substitution, thermal stability, organic semiconductor.
저자들은 이해상충이 없음을 선언합니다.
다음과 관련된 정보(GPC, calculated normalized UV/Vis spectra, normalized UV/Vis spectra, calculated front view and horizontal view of the model monomer)는 다음 사이트에서 확인할 수 있습니다(http://journal. polymer-korea.or.kr).
PK_2024_048_01_93_Supporting_Information_template.pdf (677 kb)
Supplementary Information
전도성 고분자(conductive polymer)는 금속처럼 전기적 특성을 가진 고분자로, 금속 및 반도체의 전자기적, 광학적 성질을 가진 고분자를 말하며, 단일 결합과 이중 결합이 반복되며 형성된 π-공액(conjugation) 구조를 통해 전자가 분자 간 또는 분자 내에서 자유롭게 움직일 수 있기 때문에 공액 고분자(conjugated polymer)라고도 부른다. 이러한 고분자들은 유기태양전지, 유기 열전 소자 및 트랜지스터, 유기발광 다이오드와 같이 다양한 유기 전자 재료로 활용되고 있다.1,2,3 뿐만 아니라 가볍고 유연하며 용액 공정시스템으로 인한 가격경쟁력의 장점은 스트레처블한 전자 소자의 필요성과 함께 활용 재료로써 주목받고 있다.4 최근 보고되는 공액 고분자 구조적 특징을 살펴 보면 전자가 풍부한 전자 주개(donor, D)와 전자가 부족한 전자 받개(acceptor, A)가 교대로 구성된 push/pull 타입 교대 공중합체(alternating copolymer)를 통해 밴드갭(band gap) 조절 및 전하 수송능력을 향상시키고 있다.5 이러한 구조에 사용되는 전자 주개로는 벤조디싸이오펜 (benzodithiophene, BDT)6,7과 싸이클로펜타다이싸이오펜 (cyclopentadithiophene, CDT),8 싸이에노싸이오펜(thienothiophene, TT),9 싸이오펜바이닐싸이오펜((E)-2-(2-(thiophen-vinyl)thiophene, TVT)10이 있으며, 전자 받개로는 싸이에노피롤다이온 (thienopyrroledione, TPD),11,12 다이케토피롤로피롤(diketopy- rrolopyrrole, DPP),13 벤조싸이아다이아졸(benzothiadiazole, BTZ),14 아이소인디고(isoindigo, IID),15 나프탈렌다이이미드 (naphthalenediimide, NDI)16 등이 많이 사용되고 있다. 이와 같이 다양한 D-A 조합을 통한 공액 고분자의 지속적 개발은 유기 전자 소자 활용 범위를 넓히는데 중요하며 특히 중간 밴드갭을 가지는 고분자는 적절한 흡수 파장 및 에너지 레벨로 인해 그 필요성이 높다고 할 수 있다. 뿐만 아니라 공정 과정에서 발생하는 다양한 고온 처리 방식은 고분자 재료의 열적 안정성을 필요로 하고 있다. 따라서 이러한 구조적인 디자인을 위해서는 메인 골격의 π-콘쥬게이션 길이 조절뿐만 아니라 전자밀도에 영향을 줄 수 있는 할로젠 그룹(F, Cl, I) 등이 효과적으로 공액 고분자의
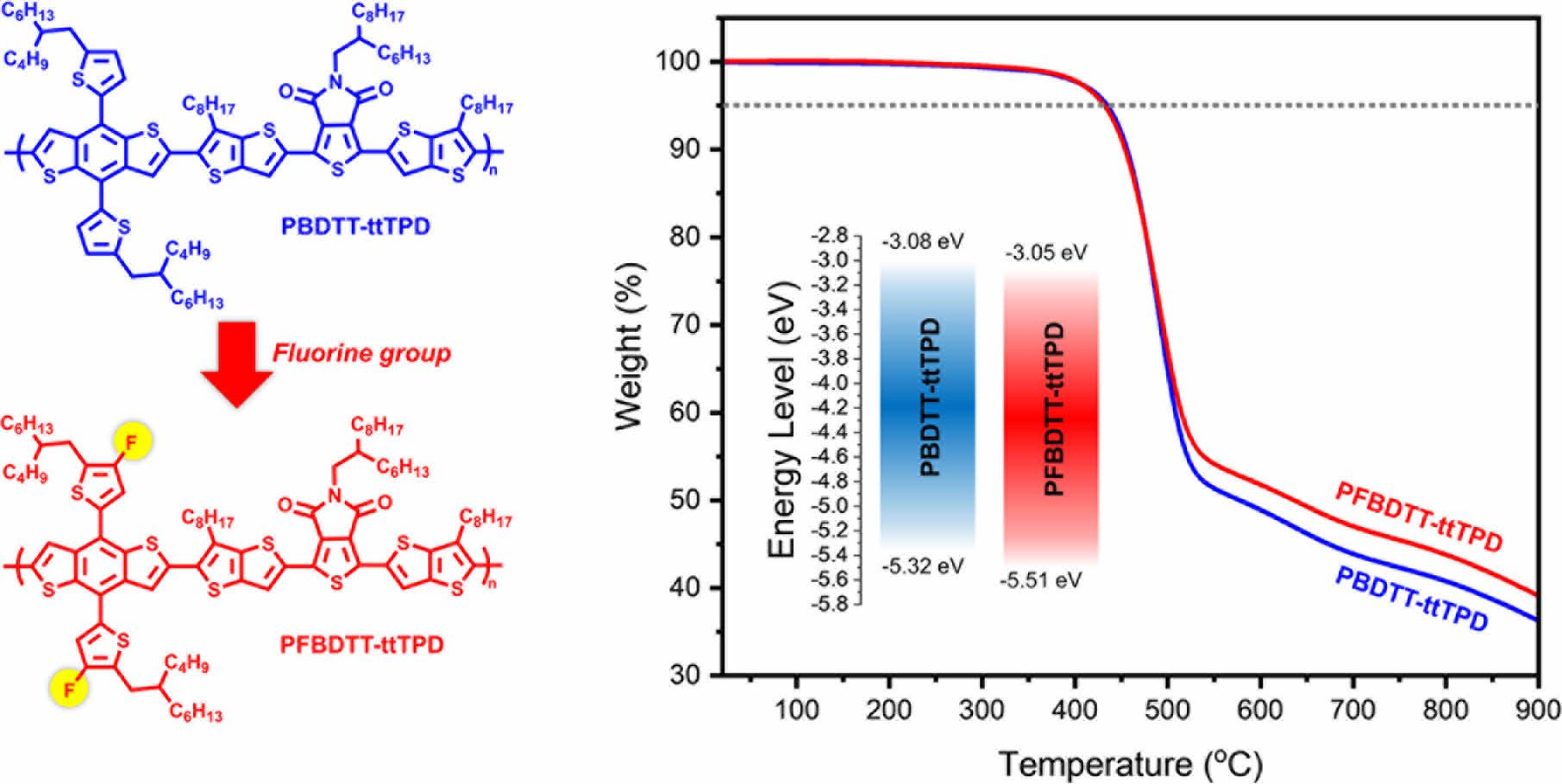
성능향상에 기여할 수 있다. 특히 불소(fluorine) 구조의 경우 HOMO/LUMO 밴드갭 조절과 함께 열안정성을 향상하는 것으로 보고되고 있다.17 본 연구진은 이러한 전자 소자 니즈에 맞는 재료를 개발하기 위해 PBDTT-ttTPD와 PFBDTT-ttTPD로 명명한 2가지 종류의 D-A 공액 고분자를 합성하였다. 구조적으로 살펴보면 좋은 평면성을 가지며 전자 전달이 뛰어난 BDT 유닛을 전자 주개로 하였고, 전자 수용 능력이 뛰어난 TPD에 흡수 영역의 확장과 전자 전달 효과를 향상하기 위해 TT 구조를 도입한 alkylthienothienyl thienopyrrolodione(ttTPD)을 전자 받개 물질로 사용하였다. PFBDTT-ttTPD의 경우 BDT 유닛에 불소 치환기를 도입함으로써 HOMO/LUMO 에너지 레벨의 변화 및 다양한 물성의 차이를 PBDTT-ttTPD와 비교하여 확인할 수 있었다.
디자인된 PBDTT-ttTPD와 PFBDTT-ttTPD는 고분자의 특성에 맞게 전통적인 가열에 의한 중합법과 마이크로 웨이브를 이용한 Stille 중합법으로 합성하였다. 합성된 고분자는 핵자기공명법(nuclear magnetic resonance, NMR)과 푸리에 변환 적외선 분광법(Fourier-transform infrared spectroscopy, FTIR)을 통해 구조를 확인하였으며 광학 및 전기화학적 특성을 자외선 분광 분석법(UV/Vis spectrophotometry)과 순환전압전류법(cyclic voltammetry, CV)을 이용하여 측정하였다. 또한 고분자 물리적 특성 측정을 위해 젤 투과 크로마토그래피(gel permeation chromatography, GPC) 및 열중량 분석(thermogravimetric analysis, TGA)으로 고분자의 분자량 및 열적 특성을 확인할 수 있었다.
실험을 통해 도출한 PBDTT-ttTPD와 PFBDTT-ttTPD의 다양한 결과는 밀도 범함수 이론(density functional theory, DFT)으로 구한 이론적인 수치와 경향성이 유사함을 확인할 수 있었다. 본 연구를 통한 결과들을 바탕으로 향후 유기반도체 분야에 새롭게 활용되길 기대한다.
시약, 재료, 기기. 중간체와 고분자 합성에 필요한 시약은 시그마-알드리치(Sigma-Aldrich)사, ㈜한국피셔과학(Thermo Fisher Scientific), 도쿄화성공업(TCI) 등에서 구매하였고, 별도의 추가 정제 없이 사용하였다. 그 중 반응 용매는 ACS 등급을 사용하였다. 1,3-Bis(5-bromo-6-octylthieno[3,2-b]thiophen-2-yl)-5-(2-hexyldecyl)-4H-thieno[3,4-c]pyrrole-4,6(5H)-dione (ttTPD)은 문헌을 참고하여 합성하였고,18 (4,8-bis(5-(2-butyloctyl)thiophen-2-yl)benzo[1,2-b:4,5-b']dithiophene-2,6-diyl)bis(trimethylstannane)(BDTT)와 (4,8-bis(5-(2-butyloctyl)-4-fluorothiophen-2-yl)benzo[1,2-b:4,5-b']dithiophene-2,6-diyl)bis(trimethylstannane)(FBDTT)은 SunaTech Inc.에서 구매하였다. 합성한 고분자의 화학 구조는 600 MHz 푸리에 변환 핵자기 공명 분석기(Agilent Superconductiong FT-NMR spectrometer system, Agilent)와 FTIR(Spectum Two, Perkin Elmer)을 이용하여 측정하였다. 광학적 특성은 자외/가시광선 분광광도계(OPTIZEN POP, mecasys)를 사용하여 클로로포름(chloroform)에 녹인 용액 상태(solution state)와 스핀 코터(spin coater EF-4op, 이플렉스)를 이용하여 석영판(quartz plate)에 코팅한 필름 상태로 각각 측정하였다. 고분자의 수 평균 분자량(Mn)과 다분산지수(poly dispersity index, PDI)는 polystyrene을 기준으로 하고 tetrahydrofuran(THF)을 이동상으로 하여 젤 투과 크로마토그래피(Agilent 1200S/miniDAWN TREOS, Agilent/Wyatt)를 통해 측정하였다. 전기화학적 특성은 순환전압전류법(Versa STAT3, AMETEK)으로 확인하였다. 기준전극(reference electrode), 작업전극(working electrode), 상대전극(counter electrode)은 Ag/Ag+, glassy carbon(GC) disk, platinum(Pt) wire로 각각 사용하였으며, 200 mV/s의 속도로 측정하였다. 전해질은 acetonitrile(ACN)에 tetra-n-butylammonium hexafluorophosphate (n-Bu4NPF6)를 용해시켜 0.1 M의 농도로 만들어 사용하였고, 기준전극(Ag/Ag+)은 페로센/페로세늄(ferrocene/ferrocenium) 산화/환원 반응으로 교정하였으며, 산화 전위는 진공 수준일 때 -4.8 eV를 기준으로 설정하였다. 고분자의 HOMO와 LUMO 준위는 HOMO(eV) = -(E(oxi)onset-E1/2 (ferrocene) + 4.8)와 LUMO(eV) = - (E(red)onset-E1/2(ferrocene) + 4.8)의 식으로 각각 계산하였다. 고분자의 HOMO/LUMO 준위, 분자 구조의 최적화, 광학적 성질 예측 등을 확인하기 위해 DFT(Gaussian 16, Becke three-parameter Lee-Yang-Parr(B3LYP) function, 6-31G basis set)를 활용하여 계산하였다. 고분자의 열적 특성은 TGA(N-1000, 신코)를 사용하여 질소 분위기에서 상온(약 16 ℃)에서부터 900 ℃까지의 온도범위로 10 ℃/min의 속도로 승온하였을 때 온도에 따른 질량 감소율을 측정하였다.
PBDTT-ttTPD합성. ttTPD(306 mg, 0.295 mmol), BDTT (300 mg, 0.295 mmol), Pd2(dba)3(8.11 mg, 8.85 μmol), tri(o-tolyl)phosphine(10.8 mg, 35.4 μmol), 그리고 anhydrous toluene 5 mL를 30 mL 마이크로웨이브 반응 용기에 첨가하였다. 반응물은 Anton-Paar 마이크로웨이브를 사용하여 110 ℃에서 3분 동안 반응하였고, 50 ℃까지 온도를 낮춘 후 500 mL methanol에 침전시켰고, 마이크로필터(0.45 μ 필터)를 사용하여 정제되지 않은 고체를 얻었다. 고분자에 포함되어 있는 불순물과 낮은 분자량을 갖는 부분을 제거하기 위해서 Soxhlet extractor를 이용하여 methanol, acetone, hexane에서 각 24시간 동안 녹아 나오는 부분을 순차적으로 제거하였고, 마지막으로 클로로포름으로 추출한 용액을 농축(10 mL)하여 methanol에서 침전, 마이크로 여과, 진공건조를 하여 고분자 PBDTT-ttTPD를 얻었다(수득률 = 66%) Mn = 84.3 kg/mol, Mw = 484.2 kg/mol, PDI = 5.74. 1H NMR(CDCl3, 600 MHz, 298.15 K): δ 7.70(d, J = 324.6 Hz, 2H), 7.01(d, J = 91.1 Hz, 4H), 2.91(s, 10H), 1.11(d, J = 249.9 Hz, 104H).
PFBDTT-ttTPD합성. ttTPD(197 mg, 0.190 mmol), FBDTT (200 mg, 0.190 mmol), Pd2(dba)3(5.22 mg, 5.7 μmol), tri(o-tolyl)phosphine(6.74 mg, 22.8 μmol), 그리고 anhydrous toluene 10 mL을 30 mL Schlenk flask에 첨가하였다. 반응물은 95 ℃에서 12시간 동안 반응하였고, 상온까지 식힌 후 500 mL methanol에 침전시킨 용액을 마이크로 필터(0.45 μ 필터)를 사용하여 정제하지 않은 고체를 얻었다. 고분자에 포함되어 있는 불순물과 낮은 분자량을 갖는 부분을 제거하기 위해서 Soxhlet extractor를 이용하여 methanol, acetone, hexane에서 각 24 시간동안 녹아 나오는 부분을 순차적으로 제거하였고, 마지막으로 클로로포름으로 추출한 용액을 농축(10 mL)하여 methanol에서 침전, 마이크로 여과, 진공건조를 하여 고분자 PFBDTT-ttTPD를 얻었다. (수득률 = 95%) Mn = 66.9 kg/mol, Mw = 366.8 kg/mol, PDI = 5.48. 1H NMR(CDCl3, 600 MHz, 298.15 K): δ 7.81(d, J = 459.2 Hz, 2H), 7.08(s, 2H), 2.91(m, 10H), 1.44(d, J = 140.1 Hz, 104H).
고분자 합성. ttTPD는 문헌에 보고된 대로 약 75%의 수득률로 합성하였다.18 Scheme 1과 같이 BDTT 또는 FBDTT를 ttTPD와 1:1 몰수 비율로 toluene에 용해시킨 후 리간드 (ligand)로는 tri(o-tolyl)phosphine를 사용하고, Pd2(dba)3를 촉매로 사용하는 Stille 중합(Stille cross coupling polymerization) 반응을 진행하여 전도성 고분자 PBDTT-ttTPD와 PFBDTT-ttTPD를 65.9%와 95.2%의 수득률로 각각 합성하였다. 클로로포름, 클로로벤젠(chlorobenzene), 다이클로로벤젠(dichlorobenzene) 등의 유기 용매에 좋은 용해도를 보이면서 최적합화된 분자량을 갖는 고분자를 합성하기 위하여 마이크로웨이브를 활용하여 고분자 중합과정을 진행하였다. 하지만 PFBDTT-ttTPD는 PBDTT-ttTPD에 비해 용해도가 상당히 낮았기 때문에 PFBDTT-ttTPD 중합과정에서는 전통적인 가열법을 사용하여 반응을 진행하였다. 합성한 PBDTT-ttTPD와 PFBDTT-ttTPD는 TT 부분에 각각 1개의 octyl 곁사슬을, TPD 부분에 hexyldecyl 곁사슬을, 그리고 BDT 부분과 결합한 thiophene에 각각 1개의 butyloctyl 곁사슬을 갖기 때문에 클로로포름, 클로로벤젠, THF 등의 유기 용매에 좋은 용해도를 보였다. 고분자의 중합도(degree of polymerization)는 GPC로 측정하였으며, PBDTT-ttTPD와 PFBDTT-ttTPD의 수평균 분자량(Mn)은 각각 84.3과 66.9 kg/mol이었고, PDI는 각각 5.74과 5.48이었다(Table 1, Figure S1).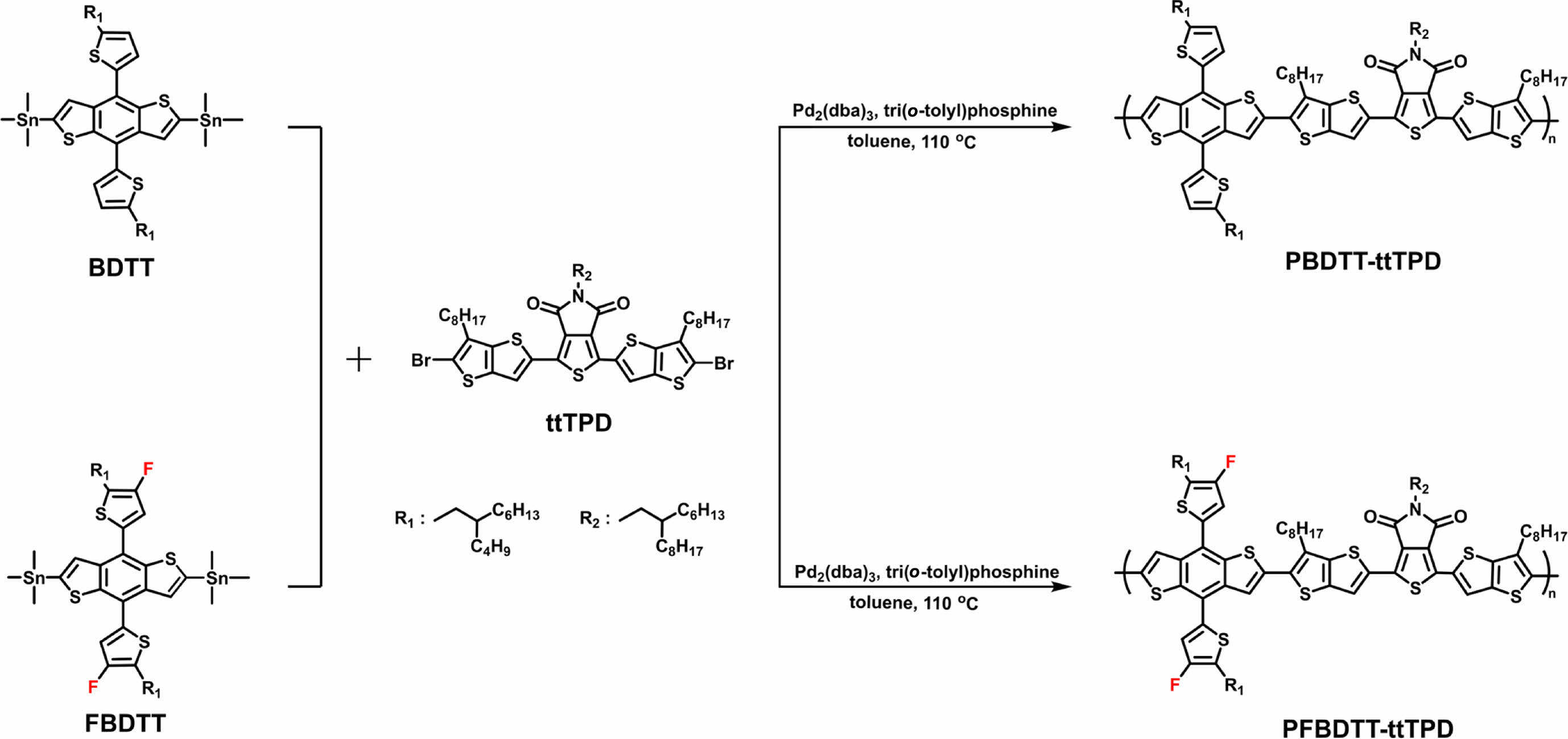
Scheme 1. Synthetic routes of PBDTT-ttTPD and PFBDTT-ttTPD.
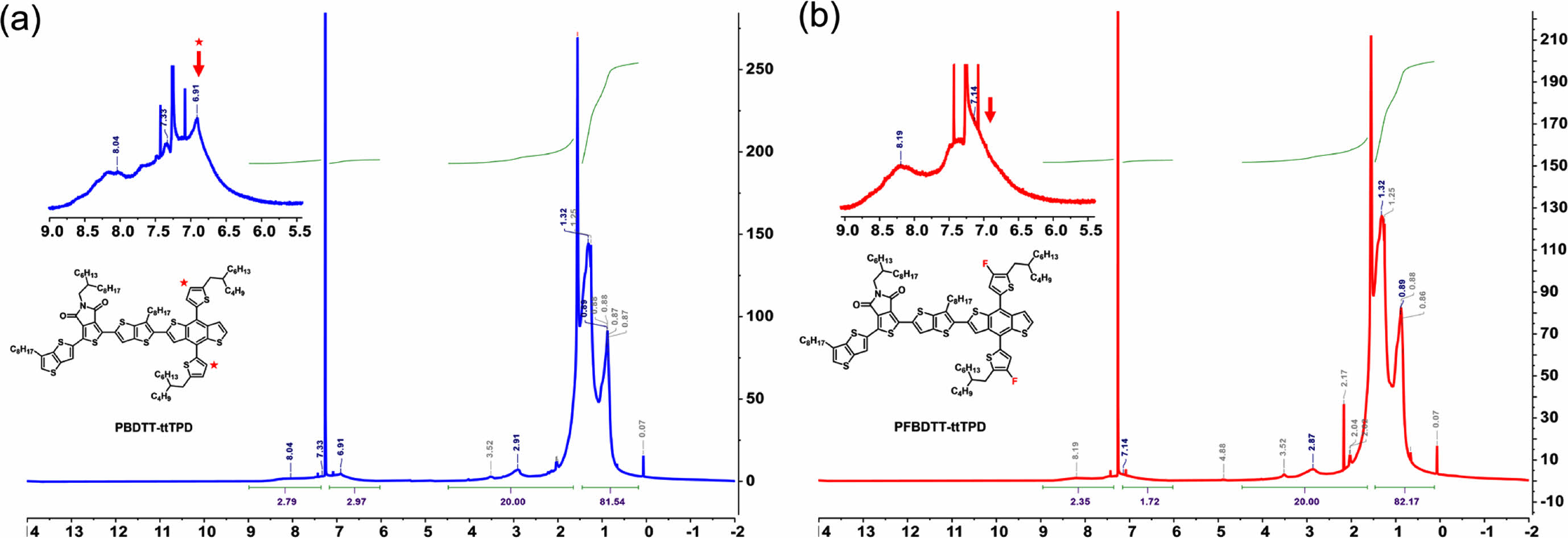
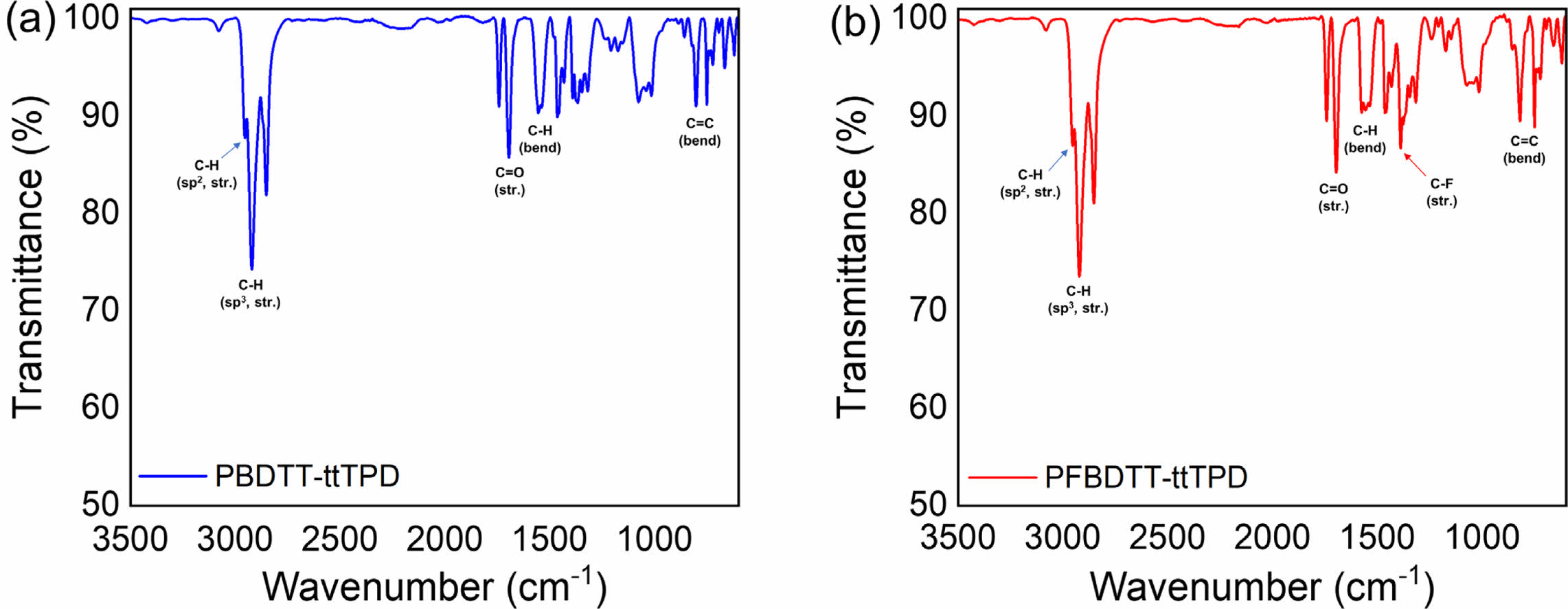
고분자 구조 분석. PBDTT-ttTPD와 PFBDTT-ttTPD의 구조를 분석하기 위해 FT-NMR에 CDCl3를 용매로 하여 측정하고, 그 결과를 Figure 1에 나타내었다. 높은 장(upfield)에서는 PBDTT-ttTPD와 PFBDTT-ttTPD의 TT, TPD, BDT의 알킬사슬의 수소가 3.57-3.38, 3.23-2.80, 2.24-0.60 ppm 영역과 3.62-3.38, 3.28-2.65, 2.22-0.60 ppm 영역에서 각각 나타나는 것을 확인하였다. 반면 PBDTT-ttTPD의 BDTT와 ttTPD를 포함한 방향족 고리의 수소는 8.69-6.82 ppm 영역에서 넓게 나타났고 PFBDTT-ttTPD에서는 해당 피크가 8.78-7.02 ppm 영역에서 비교적 좁게 나타났다. PBDTT-ttTPD는 PFBDTT-ttTPD와는 다르게 6.91 ppm 영역에서 하나의 피크가 더 갈라짐을 볼 수 있는데, 이는 PBDTT-ttTPD에서 BDTT의 싸이오펜 곁사슬의 수소에 의해서 나타나는 피크이며, PFBDTT-ttTPD에서는 관찰되지 않기 때문에 불소 치환이 성공적으로 이루어졌음을 확인하였다. 또한 FTIR을 통해 합성한 두 고분자의 작용기와 구조적 특성을 확인하였다(Figure 2). PBDTT-ttTPD와 PFBDTT-ttTPD 모두 3000-2840 cm-1 영역에서 sp3와 sp2 혼성 탄화수소의 강한 C-H 신축(stretching) 진동 피크를 관찰하였고, 1745-1697 cm-1 영역에서는 TPD의 이마이드(imide)에 해당하는 C=O 신축진동 피크를 확인할 수 있었다. 뿐만 아니라 PBDTT-ttTPD, PFBDTT-ttTPD 모두 850-600 cm-1의 지문(fingerprint)영역에서는 C=C bending을 나타내는 등 PBDTT-ttTPD와 PFBDTT-ttTPD는 전 영역에서 비슷한 피크를 확인하였으나, 1400-1000 cm-1에서는 불소로 인한 차이를 보였다. 불소가 치환되지 않은 PBDTT-ttTPD는 1389 cm-1에서 피크가 나타나지 않았으며, PFBDTT-ttTPD는 해당 영역에서 불소 치환으로 인한 얇고 강한 C-F 신축 피크가 나타남에 따라 PFBDTT-ttTPD의 합성 과정에서 불소가 성공적으로 치환되었음을 확인하였다.
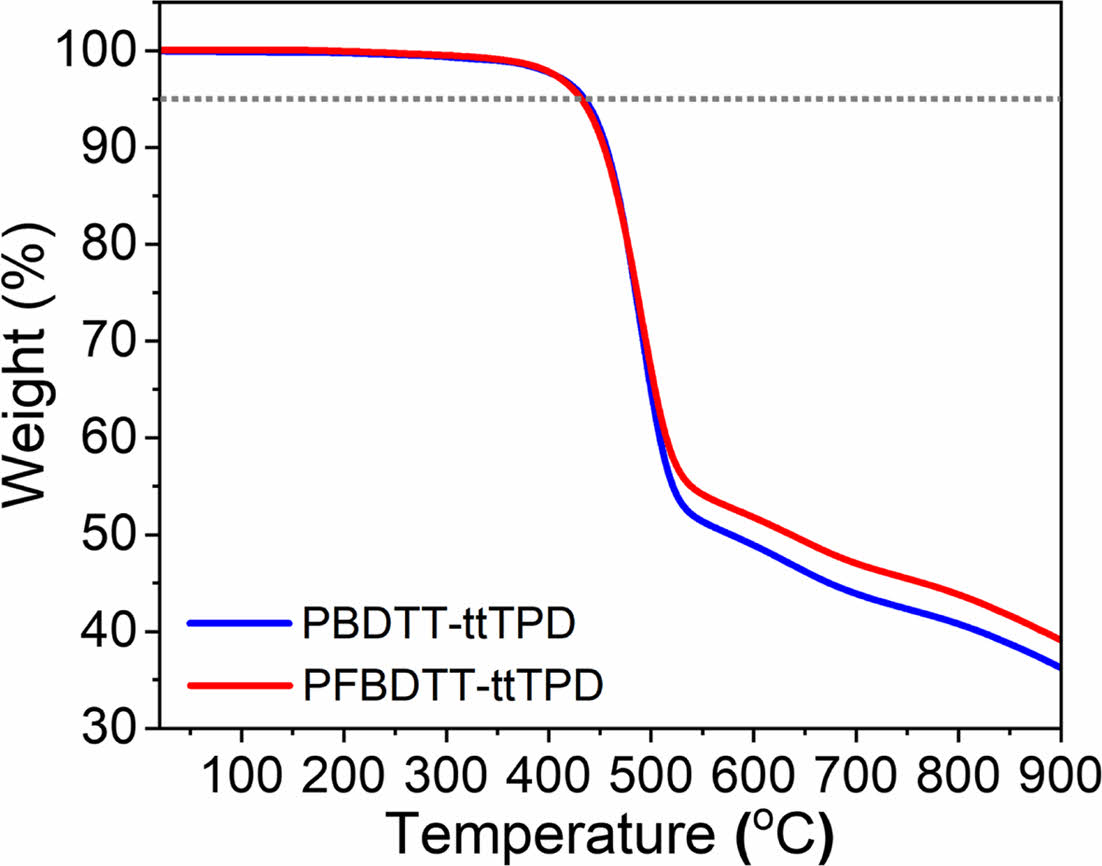
고분자 열적분석. 합성한 고분자의 열 안정성을 확인하기 위해 열분해 온도(decomposition temperature, Td)를 측정하여 확인하였다. TGA를 이용하여 질소 분위기에서 상온(16 ℃)에서부터 900 ℃까지의 온도범위로 10 ℃/min의 속도로 승온하였을 때 온도에 따른 질량 감소율을 측정하고 Figure 3와 Table 1에 나타냈다. PBDTT-ttTPD와 PFBDTT-ttTPD의 Td 값은 5% 중량 감소율을 보인 지점을 측정하였으며 합성한 두 고분자 모두 432 ℃로 매우 높은 열적 안정성을 확인했다. PBDTT-ttTPD와 PFBDTT-ttTPD의 온도에 따른 질량 감소율은 상온에서부터 500 ℃까지는 큰 차이 없이 두 고분자 모두 높은 열적 안정성을 나타내었고, 특히 500 ℃ 이상의 고온에서는 PFBDTT-ttTPD의 질량 감소가 PBDTT-ttTPD에 비해 느리게 일어나는 결과를 볼 수 있었다. 이 점에서 불소를 치환함으로써 500 ℃ 이상의 고온의 온도 범위에서 열적 안정성을 더욱 향상시켰으며, 이는 고분자의 형태가 열에 의해 분해되는 것을 예방할 수 있고 유기태양전지와 유기 전자 소자에서 물성이 변하지 않고 안정적으로 적용될 수 있을 것이다.
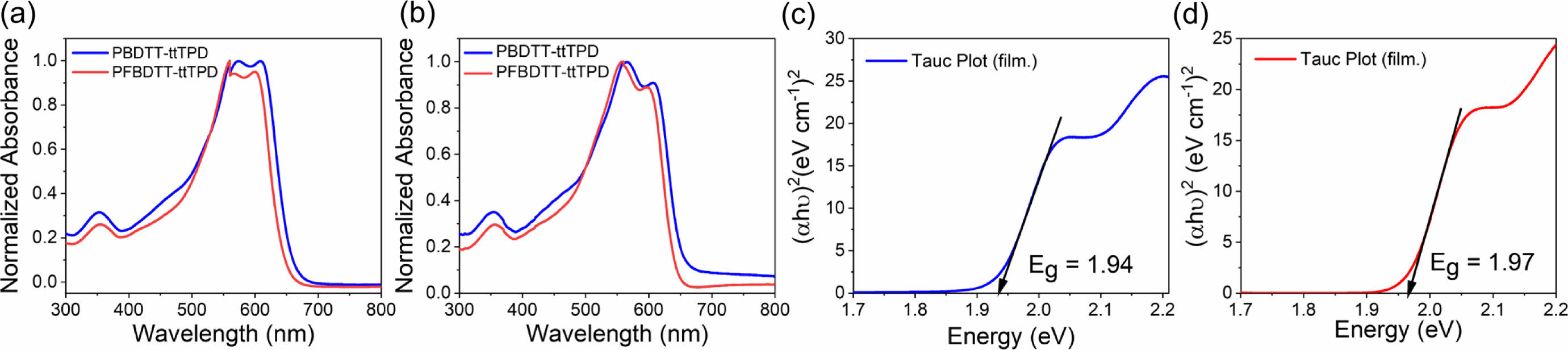
광학적 특성. 불소 유무에 따른 PBDTT-ttTPD와 PFBDTT-ttTPD의 광학적 성질을 확인하기 위하여 자외/가시광선 분광광도계(UV/Vis spectrophotometer)를 이용하여 스펙트럼을 확인하였다. 각 고분자를 클로로포름에 25 μg/mL로 희석시킨 용액상태와 클로로포름에 8 mg/mL로 용해시킨 후 석영판에 박막처리한 필름상태를 300-1100 nm 파장대에서 0.1 nm/s 스캔 간격으로 측정하였다. Figure 4에서 보는 것과 같이 일반적인 D-A 전도성 고분자에서 관찰되는 것처럼 (a) 용액상태와 (b) 필름상태 모두 상대적으로 짧은 파장인 320-400 nm에서 π–π* 전하이동(π–π* transition)을 나타내는 피크를 관찰하였고, 550-620 nm 파장에서는 분자내 전하 전달(intramolecular charge transfer, ICT)을 나타내는 피크를 각각 확인하였다. 용액상태/필름상태에서 측정한 스펙트럼의 PBDTT-ttTPD의 최대흡수파장(λmax)은 560/560 nm이고, PFBDTT-ttTPD는 560/558 nm이었다. 용액상태와는 다르게 필름상태에서의 PFBDTT-ttTPD의 최대흡수파장은 PBDTT-ttTPD에 비해 더 짧은 파장으로 이동한 청색 편이(blue shift)하는 경향을 확인하였다. 용액상태와 필름상태에서 특징적으로 관찰되는 차이점은 두 고분자 모두 긴 파장대의 vibrational transition인 0-0 shoulderpeak의 강도(intensity)가 낮아지는 것을 관찰하였다(Figure S2). 필름상태에서 Tauc plot을 통해 PBDTT-ttTPD와 PFBDTT-ttTPD의 광학적 밴드갭(Figure 4(c),(d))을 1.94와 1.97 eV로 구하였고, 그 값을 Table 1에 정리하여 나타내었다.
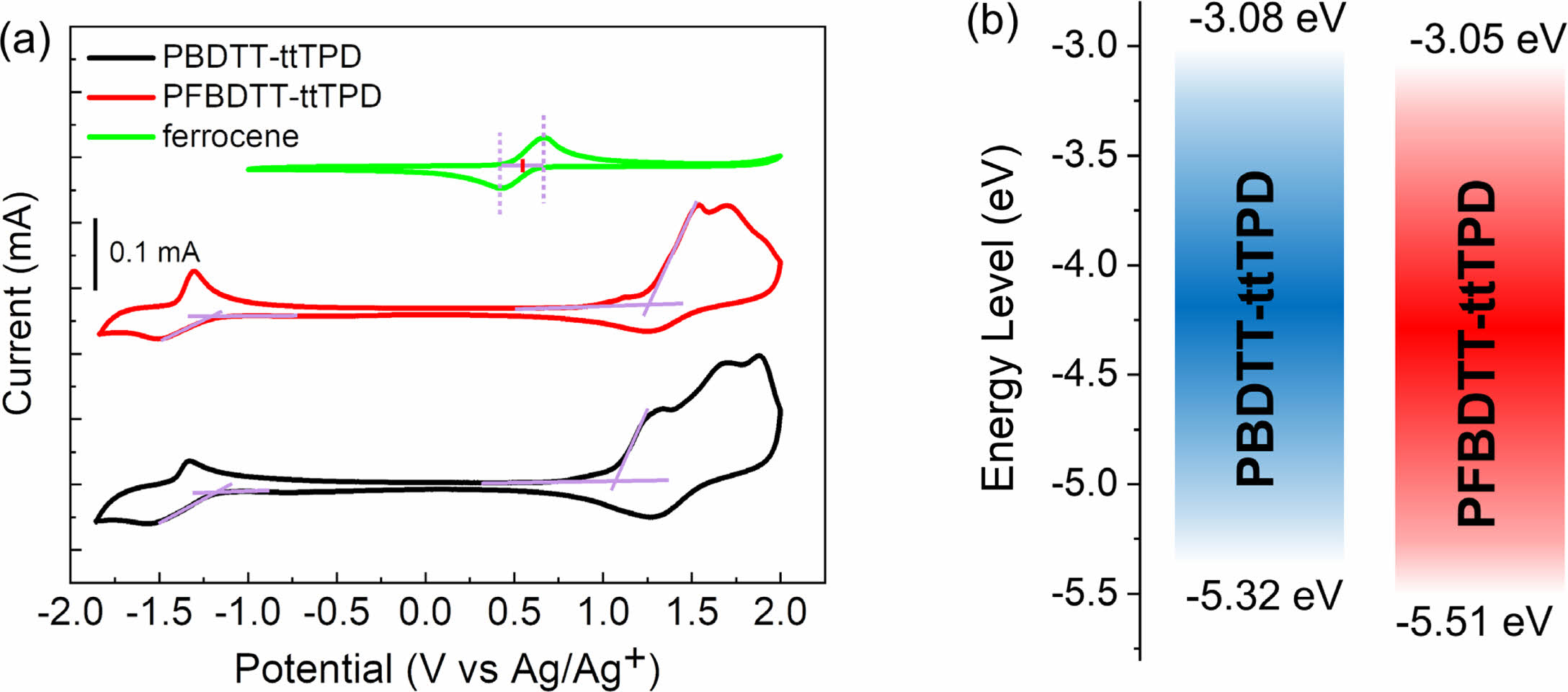
전기화학적 특성. 순환전압전류곡선(cyclic voltammetry curve)을 측정하여 고분자의 전기화학적 특성을 분석하였으며, 자세한 실험과정은 ‘시약, 재료, 기기’ 부분에 나타내었다. 순환전압전류곡선과 에너지 레벨을 비교한 그래프는 Figure 5(a)와 (b)에 각각 나타냈으며, 각 고분자의 에너지 준위를 나타낸 결과는 Table 1에 정리하였다. 식 (1), (2)에 대입하여 고분자의 highest occupied molecular orbital(HOMO)와 lowest unoccupied molecular orbital(LUMO) 에너지 준위를 각각 계산하였으며 PBDTT-ttTPD와 PFBDTT-ttTPD의 각각의 HOMO/LUMO 에너지 준위 값은 -5.32/-3.08 eV, -5.51/-3.05 eV이었다.
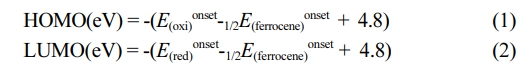
불소가 도입됨으로써 LUMO 에너지 준위는 큰 변화가 없었지만 HOMO 에너지 준위가 깊어지는 것을 확인하였다. 전기화학적 밴드갭은 PBDTT-ttTPD는 2.24 eV이고 PFBDTT-ttTPD는 2.46 eV로 불소를 갖는 PFBDTT-ttTPD의 밴드갭이 더 큰 것을 관찰하였다. 두 고분자의 광학적 밴드갭과 전기화학적 밴드갭의 차이가 나는 것은 순환전압전류법으로 고분자의 산화 및 환원 준위 측정 시 전자(electron)를 투입하고 제거하는 과정에서 Coulomb 인력의 작용 때문으로 예상된다.19
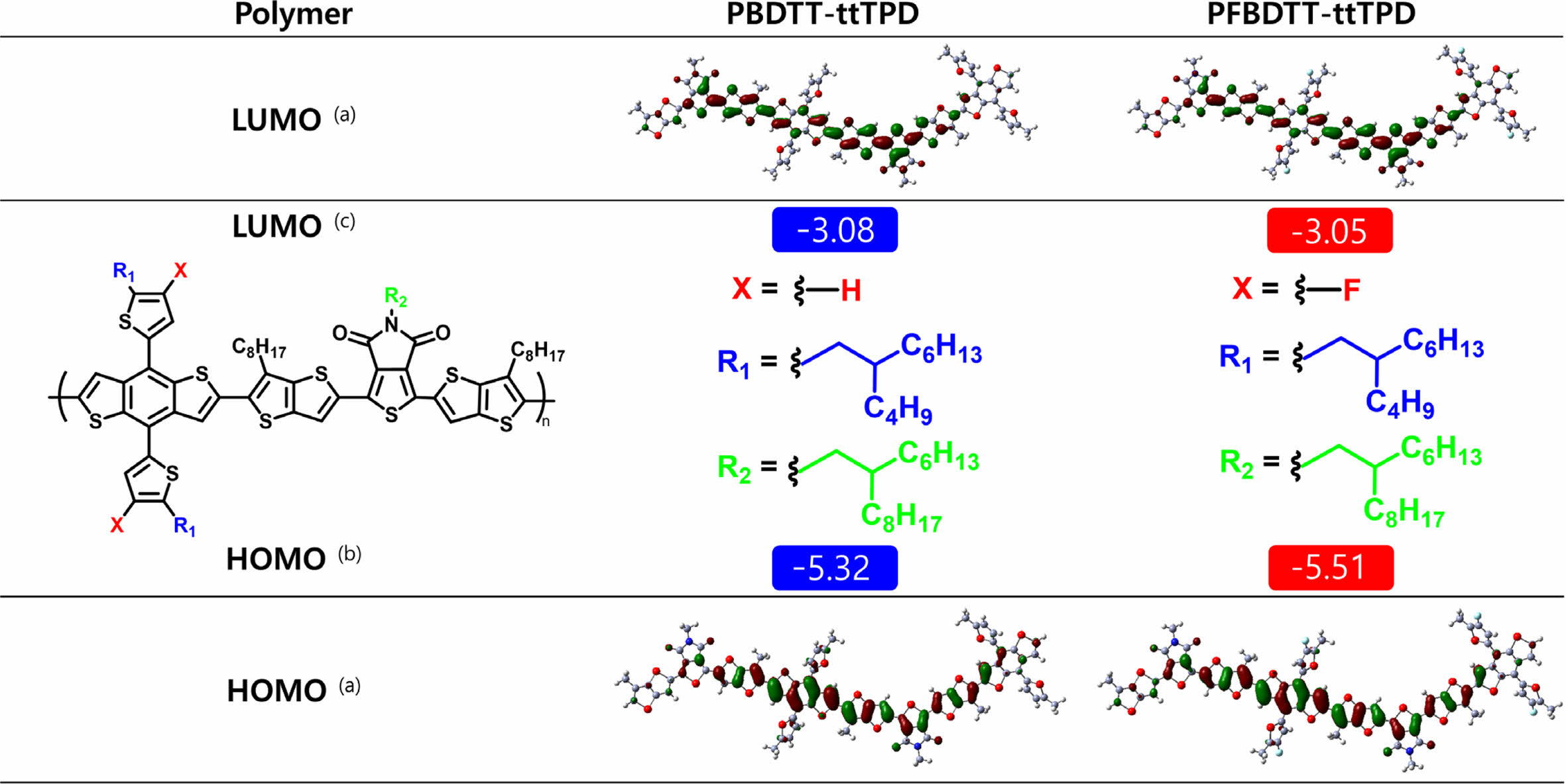
계산화학적 특성. PBDTT-ttTPD와 PFBDTT-ttTPD의 바닥상태(ground state)에서 최적화된 분자구조와 계산된 UV-Vis 스펙트럼 등을 확인하기 위해 Gaussian 16W 프로그램의 DFT, B3LYP, 6-31G basis set의 설정으로 계산을 진행하였다. 알킬 사슬의 길이 차이는 계산 결과에 영향을 주지 않기 때문에 각 고분자의 주골격이 가지는 선형 곁사슬(octyl, hexyldecyl, butyloctyl alkyl side chain)은 메틸기(methyl group)로 치환 계산을 진행하였다. Figure 6에서 보는 것과 같이 바닥상태에서 구한 HOMO와 LUMO의 charge-density isosurfaces는 불소 유무에 관계없이 비편재화되어 있는 것을 확인하였다. Time-dependent Hartree-Fock and density-functional theory (TD-SCF) DFT 계산을 통해 UV-Vis 흡수 스펙트럼을 구하였고, PBDTT-ttTPD와 PFBDTT-ttTPD가 나타내는 최대 흡수 파장을 각각 603.6, 612 nm로 확인하였다(Figure S2). 불소가 도입되면서 적색편이(red shift)되는 현상은 황(sulfur)과 불소의 상호작용(interaction)으로 인한 결과로 예상되며 TT와 BDT 사이의 이면각(dihedral angle)은 PFBDTT-ttTPD일 때 9.5687로 PBDTT-ttTPD의 11.6318 보다 작은 것을 알 수 있다. 이러한 현상은 p-orbital이 상대적으로 더 비편재화되어 적색편이 결과 값을 얻었지만 실제 실험으로 구한 필름 상태의 흡광도에서는 불소가 도입되면서 H-aggregation이 일어난 것으로 예측된다.20,21
|
Figure 1 600 MHz 1H NMR spectrum of (a) PBDTT-ttTPD; (b) PFBDTT-ttTPD in CDCl3. |
|
Figure 2 FTIR spectrum of (a) PBDTT-ttTPD; (b) PFBDTT-ttTPD. |
|
Figure 3 TGA of PBDTT-ttTPD and PFBDTT-ttTPD under N2 and heating rate of 10 ℃/min. |
|
Figure 4 Normalized UV-Vis-NIR absorption spectra of PBDTT-ttTPD and PFBDTT-ttTPD in chloroform: (a) solution; (b) film. Tauc plot of (c) PBDTT-ttTPD; (d) PFBDTT-ttTPD. |
|
Figure 5 (a) Electrochemical properties of PBDTT-ttTPD and PFBDTT-ttTPD; (b) energy diagram of PBDTT-ttTPD and PFBDTT-ttTPD. |
|
Figure 6 (a) DFT-optimized geometries and charge-density isosurfaces in ground state of the HOMO and LUMO of the PBDTT-ttTPD and PFBDTT-ttTPD at the bottom and top, respectively; (b) HOMO; (c) LUMO energy levels were measured by CV as thin films. |
|
Table 1 Optical and Electrochemical Properties of PBDTT-ttTPD and PFBDTT-ttTPD |
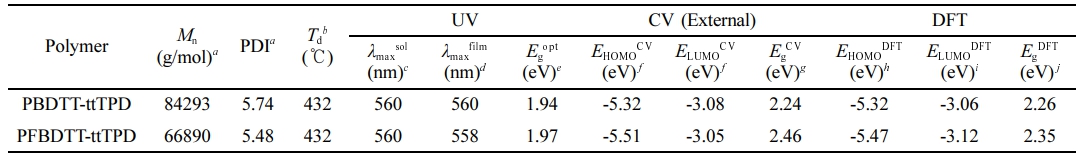
aMn and PDI of polymer were determined by GPC. b5% weight loss temperature measured by TGA under N2 atmosphere. cChloroform solution and dSpin-coated from chloroform solution. eCalculated from the absorption band edge of the polymer film, Egopt = 1240/λedgefilm. fCyclic voltammetry determined with EHOMO = -(Eoxionset-E1/2(Ferrocene) + 4.8 eV and ELUMO = -(Eredonset-E1/2(Ferrocene) + 4.8 eV). gEgCV= ELUMO-EHOMO; calculated hHOMO and iLUMO energy levels and jBand gap energy by DFT calculation. |
본 연구진은 BDT 기반한 신규 공액 고분자 2 종(PBDTT-ttTPD, PFBDTT-ttTPD)을 Stille 커플링 중합법으로 성공적으로 합성하였고 그 중 한가지에 불소 치환기를 도입하여 이에 따른 물리적 및 화학적 특성을 확인하였다. PBDTT-ttTPD와 비교해 볼 때 불소 원자의 도입이 더 낮은 HOMO 에너지 준위로 유도됨을 알 수 있었으며 열적 안정성도 두가지 고분자 모두 우수한 수치를 보였지만 500 ℃ 이상의 고온에서는 PFBDTT-ttTPD의 열적안정성이 높은 결과를 얻을 수 있었다. 이러한 결과는 다양한 유기 전자 소자에서 안정성을 높이고 성능을 향상시킬 수 있는 유기반도체 재료로 충분히 활용할 수 있음을 의미한다.
- 1. Henson, Z. B.; Müllen, K.; Bazan, G. C. Design Strategies for Organic Semiconductors beyond the Molecular Formula. Nat. Chem. 2012, 4, 699-704.
-

- 2. Lee, H.; Kang, B. Research Trends in Conjugated Polymer-Based Thermoelectric Materials. Polym. Sci. Tech. 2015, 33, 311-325.
- 3. Woo, Y. H.; Lee, H. S.; Choi, E. J.; Kim, B. S. Synthesis and Photovoltaic Properties of a Low Band Gap Polymer for Organic Solar Cell. Polym. Korea 2015, 39, 71-77.
-

- 4. Park, S. S.; Moon, S. Mo.; Son, S. Y. Recent Advances in Conjugated Polymers for Stretchable Electronics. Polym. Sci. Tech. 2022, 33, 293-296.
- 5. Tong, Y.; Xiao, Z.; Du, X.; Zuo, C.; Li, Y.; Lv, M.; Yuan, Y.; Yi, C.; Hao, F.; Hua, Y.; Lei, T.; Lin, Q.; Sun, K.; Zhao, D.; Duan, C.; Shao, X.; Li, W.; Yip, H. L.; Xiao, Z.; Zhang, B.; Bian, Q.; Cheng, Y.; Liu, S.; Cheng, M.; Ding, L. Progress of the Key Materials for Organic Solar Cells. Sci. China. Chem. 2020, 63, 758-765.
-

- 6. Kim, J.; Park, J. B.; Lee, W. H.; Kim, J. H.; Hwang, D. H.; Kang, I. N. High-Performance Fluorine-Containing BDT-Based Copolymer for Organic Solar Cells with a High Open Circuit Voltage. J. Polym. Sci. A Polym. Chem. 2017, 55, 2506-2512.
-

- 7. Shavez, M.; Panda, A. N. Assessing Effects of Different π Bridges on Properties of Random Benzodithiophene-Thienothiophene Donor and Non-Fullerene Acceptor Based Active Layer. J. Phys. Chem. A. 2021, 125, 9852-9864.
-

- 8. Lee, J. Synthesis and Characterization of Cyclopentadithiophene and Pyridylthiadiazole-Based Polymers with Single and Double Bonds. Polym. Korea 2023, 47, 487-494.
-

- 9. Murthy, L. N. S.; Kramer, A.; Zhang, B.; Su, J. M.; Chen, Y. S.; Wong, K. T.; Vandenberghe, W. G.; Hsu, J. W. P. Energy Levels in Dilute-Donor Organic Solar Cell Photocurrent Generation: A Thienothiophene Donor Molecule Study. Org. Electron. 2021, 92, 106137.
-

- 10. Chiou, D. Y.; Su, Y. C.; Hung, K. E.; Hsu, J. Y.; Hsu, T. G.; Wu, T. Y.; Cheng, Y. J. Thiophene-Vinylene-Thiophene-Based Donor-Acceptor Copolymers with Acetylene-Inserted Branched Alkyl Side Chains to Achieve High Field-Effect Mobilities. Chem. Mater. 2018, 30, 7611-7622.
-

- 11. Chang, S. W.; Muto, T.; Kondo, T.; Liao, M. J.; Horie, M. Double Acceptor Donor-Acceptor Alternating Conjugated Polymers Containing Cyclopentadithiophene, Benzothiadiazole and Thienopyrroledione: Toward Subtractive Color Organic Photovoltaics. Polym. J. 2017, 49, 113-122.
-

- 12. Zhao, C.; Yang, F.; Xia, D.; Zhang, Z.; Zhang, Y.; Yan, N.; You, S.; Li, W. Thieno[3,4-: C] Pyrrole-4,6-Dione-Based Conjugated Polymers for Organic Solar Cells. Chem. Commun. 2020, 56, 10394-10408.
-

- 13. Agneeswari, R.; Kim, D.; Tamilavan, V.; Shin, C. G.; Park, S. H.; Jin, Y. Polym. Korea 2023, 47, 79-86.
- 14. Li, M.; An, C.; Pisula, W.; Müllen, K. Cyclopentadithiophene-Benzothiadiazole Donor-Acceptor Polymers as Prototypical Semiconductors for High-Performance Field-Effect Transistors. Acc. Chem. Res. 2018, 51, 1196-1205.
-

- 15. Xu, C.; Wang, Z.; Dong, W.; He, C.; Shi, Y.; Bai, J.; Zhang, C.; Gao, M.; Jiang, H.; Deng, Y.; Ye, L.; Han, Y.; Geng, Y. Aggregation Behavior and Electrical Performance Control of Isoindigo-Based Conjugated Polymers via Carbosilane Side Chain Engineering. Macromolecules 2022, 55, 10385-10394.
-

- 16. Zhou, N.; Facchetti, A. Naphthalenediimide (NDI) Polymers for All-Polymer Photovoltaics. Mater. Today. 2018, 21, 377-390.
-

- 17. Huang, H.; Yang, L.; Facchetti, A.; Marks, T. J. Organic and Polymeric Semiconductors Enhanced by Noncovalent Conformational Locks. Chem. Rev. 2017, 117, 10291-10318.
-

- 18. Kim, J. H.; Wood, S.; Park, J. B.; Wade, J.; Song, M.; Yoon, S. C.; Jung, I. H.; Kim, J. S.; Hwang, D. H.; Optimization and Analysis of Conjugated Polymer Side Chains for High-Performance Organic Photovoltaic Cells. Adv. Funct. Mater. 2016, 26, 1517-1525.
-

- 19. Barford, W. Electronic and Optical Properties of Conjugated Polymers, 2nd Ed.; International Series of Monographs on physics; Oxford Science Publications: Oxford, 2013; pp 1-305.
- 20. Ziffer, M. E.; Jo, S. B.; Liu, Y.; Zhong, H.; Mohammed, J. C.; Harrison, J. S.; Jen, A. K. Y.; Ginger, D. S. Tuning H-and J-Aggregate Behavior in π-Conjugated Polymers via Noncovalent Interactions. J. Phys. Chem. C 2018, 122, 18860-18869.
-

- 21. Spano, F. C.; Silva, C. H- and J-Aggregate Behavior in Polymeric Semiconductors. Annu. Rev. Phys. Chem. 2014, 65, 477-500.
-

- Polymer(Korea) 폴리머
- Frequency : Bimonthly(odd)
ISSN 0379-153X(Print)
ISSN 2234-8077(Online)
Abbr. Polym. Korea - 2022 Impact Factor : 0.4
- Indexed in SCIE
 This Article
This Article
-
2024; 48(1): 93-100
Published online Jan 25, 2024
- 10.7317/pk.2024.48.1.93
- Received on Oct 20, 2023
- Revised on Nov 24, 2023
- Accepted on Nov 25, 2023
 Services
Services
Shared
 Correspondence to
Correspondence to
- Junghoon Lee* , and Kyu Cheol Lee
-
Department of Applied Chemistry·Food Science Technology, Dong-Eui University, 176 Eomgwangro, Busan 47340, Korea
*Division of Chemical Engineering, Dongseo University, Busan 47011, Korea - E-mail: junghoonlee@dongseo.ac.kr, kclee@deu.ac.kr
- ORCID:
0000-0003-2638-851X, 0009-0004-0429-0452









 Copyright(c) The Polymer Society of Korea. All right reserved.
Copyright(c) The Polymer Society of Korea. All right reserved.